 РАК ПОЛОВОГО ЧЛЕНА
РАК ПОЛОВОГО ЧЛЕНА
Рак полового члена (РПЧ) — относительно редкое заболевание, частота возникновения от 0,1 до 7,9 случая на 100 000 мужчин. Заболеваемость им существенно различается в разных географических регионах. В Европе заболеваемость составляет 0,1–0,9 случая на 100 000 мужского населения, в США — 0,7–0,9. В некоторых странах Азии, Африки и Южной Америки заболеваемость достигает 19 на 100 000 мужчин, в этих регионах рак полового члена составляет 10–20% всех онкологических заболеваний у мужчин. В то же время в странах с мусульманским вероисповеданием РПЧ встречается крайне редко [2, 22, 30].
Первичная опухоль чаще всего локализуется на головке полового члена — 85%, крайней плоти — 15%, одновременно на головке и крайней плоти — 9%, в области венечной борозды — 6%, на теле полового члена — менее чем 2%. Увеличенные лимфатические узлы пальпируются у 58% больных (20–96%). Из этих пациентов у 17–45% определяется метастатическое поражение регионарных лимфатических узлов, в то время как у остальных больных увеличение лимфатических узлов связано с присоединением вторичной инфекции. В то же время почти у 20% больных имеются микрометастазы в паховых лимфатических узлах без явных признаков их увеличения. Наличие метастазов определяется такими факторами, как глубина инвазии, уровень дифференцировки опухоли, инвазия в лимфатические или кровеносные сосуды, вовлечение в процесс пещеристых тел, а также факторами роста или совокупностью данных факторов [7, 22, 24, 30, 34, 37].
Чаще всего РПЧ метастазирует по лимфатическим путям посредством фиксации раковых эмболов в регионарных лимфатических узлах. Отдалённые метастазы возникают крайне редко и являются результатом гематогенной диссеминации. Метастазирование, как правило, происходит ступенчато: сначала появляются метастазы в паховых лимфатических узлах, затем — во внутритазовых(подвздошно-обтураторная зона). Дистанционные метастазы появляются на заключительном этапе заболевания. Таким образом, поражение внутритазовыхлимфатических узлов и отдалённые метастазы без признаков метастатического поражения паховых лимфатических узлов встречаются крайне редко [32].
При РПЧ 5-летняя выживаемость в среднем составляет 91%. Она колеблется от 94% у больных без поражения регионарных лимфатических узлов до 80% с метастазами в паховые лимфатические узлы. При наличии метастазов во внутритазовых лимфатических узлах 5-летняя выживаемость составляет 0–38,4% [37]. Летальный исход при РПЧ чаще возникает в результате развития всевозможных осложнений, таких как присоединение вторичной инфекции, кровотечение из эрозированной поверхности опухоли либо из изъязвлённых метастазов [28, 33].
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
В настоящее время не выявлено какой-либо одной достоверной причины, приводящей к развитию РПЧ. Считают, что такие факторы, как фимоз, хроническое раздражение из-за плохой гигиены полового члена, вызывают скопление смегмы в препуциальном мешке и часто сочетаются с раком полового члена. Смегма состоит из специфической бактериальной флоры (Mycobacteriumsmegmatis), свободного холестерина, жирных кислот, сложных липидов (холестериновые эфиры, нейтральные жиры, фосфатидилхолин), слущенногоэпителия головки полового члена и внутреннего листка крайней плоти. Mycobacteriumsmegmatis ассимилируют холестерин, входящий в состав смегмы, и превращают его в стерины, являющиеся канцерогенами.
В то же время иссечение крайней плоти (обрезание) — обязательный обряд в некоторых странах с мусульманским и иудаистским вероисповеданием предохраняет от возникновения данного заболевания. Отмечена взаимосвязь персистенции вируса папилломы человека типов 16 и 18 с развитием рака полового члена: инвазивный рак полового члена, а также бородавчатого и базального вариантов рака полового члена сочетается с наличием вируса в 50% случаев; сочетание карциномы insitu, плоских и остроконечных кондилом с персистенцией данных вирусов составляет более 90%. У мужчин, лечение псориаза у которых проводилось ультрафиолетовыми лучами, а также препаратом псорален, возрастает риск развития РПЧ [2, 12, 30, 34].
ПРОФИЛАКТИКА
Основные мероприятия по профилактике развития рака полового члена:
- устранение фимоза как основной причины застоя смегмы в препуциальном мешке;
- ежедневная гигиена и туалет наружных половых органов.
СКРИНИНГ
Ежегодные диспансерные осмотры взрослого населения мужского пола с участием врача-уролога.
КЛАССИФИКАЦИЯ
Основная гистологическая форма рака полового члена — плоскоклеточный рак, который составляет 95% всех новообразований полового члена. Значительно реже встречаются злокачественная меланома и базально-клеточныйрак. Мезенхимальные опухоли (саркома Капоши, ангиосаркома, эпителио-иднаягемангиоэндотелиома) встречаются очень редко — менее 3% [30, 34].
Предопухолевые заболевания полового члена можно разделить на факультативные (с низким риском развития РПЧ) и облигатные (с высоким риском развития РПЧ). К факультативным предопухолевым заболеваниям относятся кожный рог и папилломы полового члена. Облигатными заболеваниями считаются внутриэпителиальная неоплазия полового члена — эритроплазияКвейрата, болезнь Боуэна и облитерирующий балантит [29].
Гистологическая классификация
Эпителиальные новообразования
- Предраковые:
- рак insitu (эритроплазияКвейрата и болезнь Боуэна);
- папулёзныйбоуеноид полового члена. ?
- Плоскоклеточный рак:
- обычный тип;
- папиллярный рак;
- веррукозный рак;
- бородавчатый (кондиломатозный) рак;
- базалоидный рак;
- саркоматоидный рак;
- аденосквамозный рак;
- смешанный рак.
- Базально- клеточный рак (базалиома).
- Болезнь Педжета.
- Другие редкие типы рака.
Новообразования из меланоцитов
- Невус.
- Меланома.
Классификация TNM
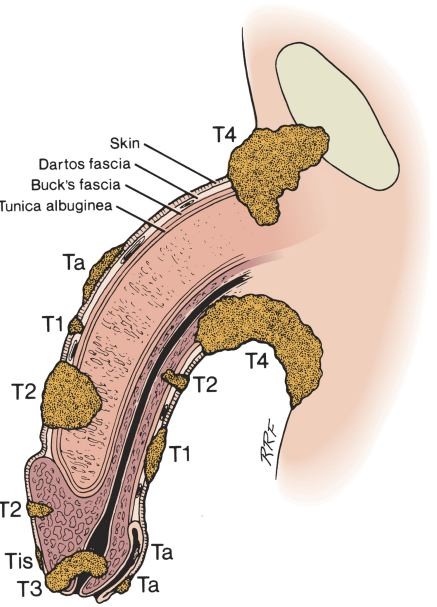
Т — первичная опухоль
- Тх — недостаточно данных для оценки первичной опухоли.
- Т0 — нет первичной опухоли.
- Тis — преинвазивная карцинома (карцинома insitu ).
- Та — неинвазивная бородавчатая карцинома.
- Т1 — опухоль распространяется на субэпителиальную соединительную ткань.
- Т2 — опухоль распространяется на губчатое или пещеристое тело.
- Т3 — опухоль распространяется на уретру или предстательную железу.
- Т4 — опухоль распространяется на другие окружающие структуры.
N — регионарные лимфатические узлы (поверхностные и глубокие паховые и тазовые лимфатические узлы)
- Nх — недостаточно данных для оценки состояния регионарных лимфатических узлов.
- N0 — нет признаков поражения метастазами регионарных лимфатических узлов.
- N1 — метастаз в один поверхностный паховый лимфатический узел. ?
- N2 — метастазы в несколько поверхностных паховых лимфатических узлов или метастазы с обеих сторон.
- N3 — метастазы в глубокие паховые лимфатические узлы или метастазы в лимфатический узел (узлы) таза с одной или с обеих сторон.
М — отдалённые метастазы
- Мх — недостаточно данных для определения отдалённых метастазов.
- М0 — нет признаков отдалённых метастазов.
- М1 — имеются отдалённые метастазы.
G — гистологическая градация (уровень дифференцировки клеток опухоли)
- Gх — недостаточно данных о дифференцировке клеток опухоли.
- G1 — высокодифференцированная опухоль.
- G2 — умеренно дифференцированная опухоль.
- G3–4 — низкодифференцированная или недифференцированная опухоль.
Группировка РПЧ по стадиям представлена в табл. 1.
Таблица 1. Группировка РПЧ по стадиям
|
Стадия |
Т |
N |
M |
| Стадия 0 | Тis | N0 | М0 |
| Та | N0 | М0 | |
| Стадия I | Т1 | N0 | М0 |
| Стадия II | Т1 | N1 | М0 |
| Т2 | N0 | М0 | |
| Т2 | N1 | М0 | |
| Стадия III | Т1 | N2 | М0 |
| Т2 | N2 | М0 | |
| Т3 | N0 | М0 | |
| Т3 | N1 | М0 | |
| Т3 | N2 | М0 | |
| Стадия IV | Т4 | Любая N | М0 |
| Любая Т | N3 | М0 | |
| Любая Т | Любая N | М1 |
КЛИНИЧЕСКАЯ КАРТИНА
Поскольку опухоль развивается на наружных половых органах, диагностика не вызывает особых трудностей. У больных без врождённого сужения препуциального мешка в начальном периоде болезни превалируют жалобы на появление на головке полового члена или внутренней поверхности крайней плоти патологических образований: эрозий, язвочек, папиллом, узелков, трещин или уплотнений бледного или красноватого цвета. Появившиеся образования могут быть покрыты сероватым налётом, коркой, выделять серозную жидкость. Мужчины с врождённым фимозом как первое проявление болезни отмечают гнойные выделения из закрытого препуциального мешка, прощупываемое внутри его уплотнение. Особенностью РПЧ является то, что опухолевый процесс практически во всех случаях сопровождает воспаление, начиная с ранних стадий рака.
Патологическое образование может быть безболезненным. При этом, даже несмотря на наличие плотного, заметного на глаз образования, больные редко обращаются к врачу. Настораживают мужчин симптомы, возникающие при дальнейшем росте РПЧ. При прорастании опухолью мочеиспускательного канала или пещеристых тел возникают расстройство мочеиспускания, приапизм. Больные предъявляют жалобы на напряжённое мочеиспускание, слабость или узость струи, её разбрызгивание, зуд, жжение, неприятные ощущения во время мочеиспускания, длительную эрекцию.
Общее состояние пациентов долгое время остаётся вполне удовлетворительным. При распаде опухоли заметно усиливается параканкрозноевоспаление, которое усугубляет течение болезни. При этом обращают на себя внимание обильные серозно-гнойные выделения из препуциального мешка с неприятным запахом, изъязвление крайней плоти с образованием свищевых ходов. Встречаются также перфорации препуциального мешка с разрастающимися опухолевыми тканями. Пациенты обращаются также к врачу с жалобами на увеличение паховых лимфатических узлов, их болезненность, слияние в конгломерат с развитием некроза и появлением свищевых ходов с зловонным некротическим отделяемым.
Кахексия возникает лишь на самых поздних стадиях РПЧ, когда распаду подвергается не только первичный опухолевый очаг, но и регионарные метастазы.
ДИАГНОСТИКА
В целях детальной диагностики РПЧ важно принимать во внимание особенности первичного очага опухоли, регионарных и отдалённых метастазов.
Первичный очаг
Пациенты с любыми изменениями покровного эпителия полового члена должны пройти тщательное физикальное обследование. Этого часто бывает достаточно для того, чтобы не только поставить диагноз, но и провести дифференциальную диагностику по стадии и определить первоначальный план лечения. При первичном осмотре необходимо определить:
- размер первичного очага или подозрительной области;
- локализацию опухоли на половом члене;
- число опухолевых образований;
- внешний вид — сосочковые, узловые, в виде язвы или плоские;
- связь с другими структурами — подслизистой основой, пещеристыми либо губчатыми телами, уретрой;
- цвет, форму очагов, а также наличие возможных наложений (фибрин, корки, гнойное или серозное отделяемое).
Гистологическое или цитологическое исследование абсолютно необходимо для выбора тактики лечения. Цель данных исследований — не только установление патоморфологического диагноза, но и определение уровня дифференцировки опухолевых клеток, что чрезвычайно важно для выбора лечебной тактики. Можно использовать различные методы биопсии — инцизионную, щипковую, игольчатую аспирацию, взятие мазков-отпечатков. Эксцизионнаябиопсия (удаление всего очага) также может быть использована для взятия материала при его небольших размерах и расположении на визуализируемых досягаемых участках [26, 27].
УЗИ, а также МРТ могут быть полезны для определения уровня опухолевой инвазии, особенно в случае инфильтрации кавернозных тел. При диагностике микроскопической инвазии кавернозных тел результаты УЗИ следует интерпретировать осторожно.
Регионарные лимфатические узлы
Обязательна пальпация паховых лимфатических узлов, которая может дать следующие результаты.
Непальпируемые лимфатические узлы. Нет ориентиров для гистологического исследования или методик визуализации (УЗИ, МРТ), если лимфатические узлы не увеличены и не пальпируются. Если в первичной опухоли прогностические факторы были плохие (низкий уровень дифференцировки, глубокая инвазия опухоли), рекомендуют провести инцизионную биопсию паховых лимфатических узлов при помощи лимфосцинтиграфии. Для этого в область первичного поражения вводят раствор красителя (метиленового синего) и через 20–24 ч удаляют лимфатические узлы, накопившие краситель, с их гистологическим исследованием. Можно также использовать радиоизотопную лимфосцинтиграфию. В данной ситуации применяют коллоидный раствор препарата, меченного изотопом 99mТс. Лимфатические узлы, накопившие радиофармпрепарат, обнаруживают при помощи счётчика гамма- квантов. Последний метод диагностики предпочтительнее, так как показал 100% специфичность при чувствительности 78–80% [1, 18, 23, 35].
Пальпируемые лимфатические узлы.При наличии пальпируемых лимфатических узлов необходимо определить:
- диаметр лимфатических узлов (или конгломерата);
- уни- или билатеральную локализацию;
- число лимфатических узлов в каждой паховой области;
- подвижность или несмещаемость лимфатических узлов (или конгломерата);
- связь с другими структурами (кожей, паховой связкой);
- наличие отёка на нижней конечности и/или на мошонке.
Как правило, у больных с пальпируемыми паховыми узлами в 50% случаев выявляют реактивно изменённые лимфатические узлы. При динамическом наблюдении за больным после проведённого лечения все появившиеся увеличенные паховые лимфатические узлы являются метастатическими. Таким образом, наблюдение за регионарными лимфатическими узлами необходимо продолжать ещё несколько недель после окончания лечения первичной опухоли с тем, чтобы прошёл период, необходимый для регрессии воспалительного процесса [10, 21, 25].
Для морфологического исследования регионарных лимфатических узлов следует выполнить игольчатую аспирационную или открытую инцизионнуюбиопсию. В случае отрицательного результата при наличии клинически подозрительных лимфатических узлов показана повторная биопсия. Для получения более точного результата биопсии следует применять лучевые методы визуализации (УЗИ, КТ, МРТ) [3, 18].
Отдалённые метастазы
Диагностику отдалённых метастазов необходимо проводить у тех больных, у которых доказано их наличие. КТ органов таза и брюшной полости выполняют для определения состояния внутритазовых и забрюшинных лимфатических узлов у больных с наличием паховых метастазов. Рентгенографию грудной клетки также необходимо выполнить у пациентов с наличием метастазов в паховых лимфатических узлах. Сцинтиграфия скелета показана только при наличии со-ответствующих симптомов (боль в костях, спонтанные переломы) [24, 25, 30].
Алгоритм диагностики
Алгоритм диагностики РПЧ представлен в табл. 2 [37].
Таблица 2. Алгоритм диагностики рака полового члена
|
Обязательные методы исследования |
Рекомендуемые методы исследования |
Дополни тельные методы исследования |
|
| Первичная опухоль | Физикальное обследование, биопсия с цитологической или гистологической верификацией. SCC-опухолевый маркёр | УЗИ (при подозрении на инвазию пещеристого тела) | МРТ (при неэффективности УЗИ) |
|
Регионарные метастазы |
|||
| Пальпируемые | Физикальноеобследование, биопсия с цитологической или гистологической верификацией | Биопсия сторожевых лимфатических узлов | |
| Непальпируемые | Радиоизотопная лимфосцинтиграфия. КТ органов малого таза | ||
|
Обязательные методы исследования |
Рекомендуемые методы исследования |
Дополни тельные методы исследования |
|
| Отдалённые метастазы | КТ малого таза (при наличии паховых метастазов). КТ брюшной полости (при наличии внутритазовых метастазов).Рентгенография грудной клетки (при наличии регионарных метастазов). Сцинтиграфияскелета (при наличии симптомов поражения костной ткани) | ||
ЛЕЧЕНИЕ
Интраэпителиальная неоплазия полового члена (Tis)
При раке insituпоказано органосохраняющее лечение. Рекомендуются следующие методики [8, 15, 30]:
- локальная лазеротерапия (CO2— или Nd:YAG-лазер);
- криодеструкция;
- фотодинамическая терапия;
- локальная эксцизия очага;
- местное применение химиопрепаратов (крем с 5-фторурацилом).
Выбор того или иного воздействия зависит от предпочтений самого хирурга и больного, размеров очага, глубины инвазии и наличия необходимого оборудования.
Опухоли Та–1G1–2
Больным, за которыми после лечения проводят регулярное наблюдение, показаны органосохраняющие методики лечения. К ним относятся лазерная деструкция опухоли, локальная эксцизия с реконструктивной операцией, дистанционная лучевая или брахитерапия, ампутация головки полового члена. При частичной ампутации необходимо отступить не менее чем на 2 см от края опухоли; размер, на который нужно отступить, может варьировать в зависимости от уровня дифференцировки опухоли. Так, при G1 10 мм резерва будет вполне достаточно, а при G3 — только не менее 15 мм резерва сможет гарантировать отсутствие опухоли по краю резекции. При использовании лучевой или лазеротерапии вероятность излечения с органосохраняющим эффектом составляет 55–84%. Вероятность возникновения локального рецидива при использовании дистанционной лучевой, брахитерапии и лазерного воздействия составляет 15–25%. При применении традиционной хирургии вероятность локальных рецидивов составляет 11–50%. Гистологический контроль за состоянием краёв резекции позволяет снизить этот показатель до 9–24%. Регулярное дальнейшее наблюдение строго обязательно, так как очень важно своевременно диагностировать локальный рецидив РПЧ и начать его лечение. Как правило, локальные рецидивы при их своевременной диагностике и лечении не ухудшают показатели 5-летней выживаемости.
Больным, у которых невозможно провести тщательное дальнейшее наблюдение в динамике, следует рекомендовать частичную ампутацию полового члена [5, 8].
Лечение опухолей Т1 G3, Т ?2
Стандартный метод лечения — частичная или полная ампутация полового члена или эмаскуляция в зависимости от объёма поражения. Только у больных с распространением опухоли не более чем на половину головки полового члена возможно проведение органосохраняющего лечения с обязательным строгим динамическим наблюдением [22, 25, 31].
Локальный рецидив
Если после проведения органосохраняющего лечения развивается локальный рецидив, проведение повторного органосохраняющего лечения возможно только при исключении опухолевой инвазии кавернозных тел. При наличии глубокой опухолевой инвазии (инвазия кавернозного тела и глубже) или большого опухолевого очага показана частичная либо полная ампутация полового члена. Основные факторы при выборе органосохраняющей тактики лечения рака полового члена на начальной стадии — простота, удобство выполнения, личный опыт хирурга, а также наличие необходимой аппаратуры [31].
Лучевая терапия
Её можно использовать как самостоятельный метод лечения на начальных стадиях заболевания и как компонент комбинированного метода лечения.
У больных с поражением кожи без инфильтрации пещеристых тел либо без их глубокой инвазии надежды на стойкое излечение весьма велики. В таких случаях осуществляют только наружное облучение либо прибегают к сочетанной лучевой терапии. Начинают с наружного облучения.
Мишень включает зону поражения плюс 2–3 см на неизменённую кожу. Предпочтительнее облучение электронами, но возможно при отсутствии таковых использовать дистанционную гамма-терапию. Ежедневная доза должна составлять не более 2–3 Гр во избежание ранних реакций со стороны окружающих нормальных тканей. Суммарную дозу доводят до 60 Гр.
При поражении кожи полового члена в большинстве случаев, как и при раке кожи других локализаций, достигается излечение. Часто используют расщеплённый курс.
При инфильтрации пещеристого тела или наличии остаточной опухоли прибегают затем к контактному аппликационному облучению. Для этого изготавливают специальные маски. Суммарная доза — 30 Гр.
Если изначально известно об инфильтрации пещеристых тел и планируется сочетанная лучевая терапия, суммарную дозу от наружного облучения снижают до 50 Гр и затем контактно подводят не менее 30 Гр.
При небольших остаточных опухолях кожи полового члена после подведения 60 Гр лучше всего завершить лечение фотодинамическим воздействием.
У больных с большими поражениями и глубокой инфильтрацией пещеристых тел к предоперационному дистанционному облучению в дозе 40–50 Гр прибегают только в случае сомнений в радикализме ампутации полового члена, например при распространении опухоли на основание полового члена. Если ампутация сможет обеспечить излечение, проведение предоперационного облучения излишне.
При отсутствии клинических данных об опухолевом поражении паховых лимфатических узлов и самостоятельном лучевом лечении паховые лимфатические узлы подвергают облучению с отдельных полей при использовании электронных пучков либо включают в единое поле с первичным очагом при дистанционной гамма-терапии. Поскольку наличие микрометастазовв регионарных узлах вероятно, к ним подводят дозу не менее 60 Гр. Такая тактика оправданна, если излеченный больной может находиться под строгим динамическим наблюдением, поскольку микрометастазы нередко развиваются и после подведения указанной дозы. В противном случае выполняют превентивную пахово-бедренную лимфаденэктомию.
При наличии регионарных метастазов более стойкого лечения удаётся добиться при использовании комбинированного воздействия: предоперационного облучения с последующейлимфаденэктомией, которую по показаниям расширяют до подвздошно-пахово-бедренной. В этих случаях подводят СОД 40 Гр, поскольку при эскалации дозы развиваются выраженные лучевые ре-акции кожи паховых зон, что неоправданно отодвигает выполнение основного этапа комбинированного лечения — операции.
Развитие отдалённых осложнений (рубцевание, некроз кожи) встречается нередко. Использование отдельной методики позволяет достичь лучших результатов по сравнению с комбинацией дистанционной лучевой и брахитерапии [5, 19, 36].
Наиболее частыми осложнениями данного метода являются рубцевание (15–30%), стриктуры уретры (20–35%), телеангиэктазии (более 90%), а также поздние лучевые изменения в виде некрозов, которые зачастую бывает сложно дифференцировать с рецидивом опухоли [5, 19, 36]
Регионарные лимфатические узлы
При РПЧ успех в лечении, а также прогноз зависят от состояния лимфатических узлов. Радикальнаялимфаденэктомия — стандартное лечение больных с метастазами в лимфатические узлы [22]. При этой операции границы резекции следующие: паховая связка, приводящая мышца, портняжная мышца, а также бедренная вена и артерия. Однако её выполнение сопряжено с высоким риском развития осложнений, вплоть до смертельного исхода (30–50%), даже при использовании современных методик вмешательства. При лимфаденэктомии рекомендуют закрывать бедренные сосуды влажными салфетками во избежание некроза их стенки. На бедренную артерию нужно положить салфетку, смоченную 0,25% раствором прокаина во избежание спазма артерии и развития аортального тромбоза. Лучше использовать негрубые ретракторы для кожи во избежание её некроза. После выполнения лимфаденэктомиисосудисто нервный пучок удобнее закрывать портняжной мышцей. Как до, так и после операции показано назначение антикоагулянтной терапии.
Непальпируемые лимфатические узлы
Анализ данных показал наличие трёх групп риска возникновения регио-нарных метастазов [28, 31, 32].
- Низкий риск развития регионарных метастазов. К данной группе относят больных с характеристикой первичного очага pTis, pTaG1–G2, pT1G1. Вероятность возникновения метастазов у этих больных составляет менее 16,5%. Больным данной группы, у которых невозможно проводить динамическое наблюдение в силу различных обстоятельств, показана паховая лимфаденэктомия.
- Средний риск развития регионарных метастазов. К данной группе относят больных с характеристикой первичного очага pТ1G2. Риск наличия регионарных метастазов в данной группе достигает 30%. У больных без признаков сосудистой или лимфатической инвазии опухоли по данным гистологического исследования первичного очага рекомендуют тщательное обследование. При инвазии опухоли в лимфатические или кровеносные сосуды показана паховая лимфаденэктомия. Если возможно дальнейшее динамическое обследование, больным данной группы можно выполнить биопсию лимфатических узлов под контролем радиоизотопной лимфосцинтиграфии с 99mТс. При отсутствии признаков метастазирования по данным биопсии рекомендуют выжидательную тактику в отношении лимфаденэктомии под контролем обязательного динамического наблюдения.
- Высокий риск регионарного метастазирования. В эту группу входят больные с характеристиками опухолевого очага рТ ?2 или рТ1G3. Риск определения метастазов в лимфатических узлах составляет 68–73%. В данном случае обязательно выполнение радикальной паховой лимфаденэктомии, которая может быть расширена до тазовой (может быть выполнена лапароскопическая тазовая лимфаденэктомия) при наличии метастазов в лимфатических узлах при плановом гистологическом исследовании. Границы тазовой лимфаденэктомии: сверху — бифуркация подвздошных сосудов, медиально — обтураторный нерв, латерально — подвздошно-паховый нерв.
Пальпируемые лимфатические узлы
При определении позитивных лимфатических узлов (по данным биопсии) обязательно выполнение паховой лимфаденэктомии. Выполнение отсроченной или одновременной тазовой лимфаденэктомии показано при обнаружении двух и более метастазов в паховых лимфатических узлах или инвазии опухоли за пределы капсулы лимфатического узла. В данной ситуации вероятность наличия метастазов в тазовых лимфоузлах повышается до 30%. Так, при наличии 2–3 метастазов в паховых лимфатических узлах вероятность тазового метастазирования составляет 23%, при наличии более трёх поражённых паховых лимфатических узлов — 56%. В данном случае вероятность из-лечения снижается до 14–54% [32].
С контралатеральной стороны при отсутствии пальпируемых лимфатических узлов лимфаденэктомию следует выполнять изначально, и она может быть расширена до тазовой при обнаружении метастазов в паховых лимфатических узлах при плановом гистологическом исследовании.
Фиксированные паховые конгломераты или позитивные тазовые лимфатические узлы (по данным КТ и МРТ )
При наличии объёмных образований в паховых областях (метастазы) или увеличенных лимфатических узлах таза (по данным КТ и МРТ) показана адъювантная химиотерапия, которая может привести к частичной или полной регрессии опухоли в 21–60% случаев [13]. Паллиативная пахово-подвздошно-обтураторная лимфаденэктомия — обязательный метод лечения. Другим ва-риантом лечения в данной ситуации является предоперационная лучевая терапия с последующей лимфаденэктомией. Однако необходимо учитывать статистически достоверное повышение смертности больных от лимфаденэк-томии после лучевой терапии [36].
Появление пальпируемых лимфатических узлов в период динамического наблюдения
Если при очередном обследовании у больного выявляют увеличенные паховые лимфатические узлы, это свидетельствует об их метастатическом поражении практически в 100% случаев. В данной ситуации показаны следующие методы лечения [4].
- Двусторонняя радикальная лимфаденэктомия по вышеописанным критериям.
- Паховаялимфаденэктомия на стороне позитивных лимфатических узлов при наличии длительной ремиссии. Метастазирование в паховые области происходит синхронно с двух сторон или с небольшим интервалом. Таким образом, если в процессе длительного наблюдения за пациентом у него появляются метастазы в паховых лимфатических узлах с одной стороны, то вероятность их развития с контралатеральной стороны по истечении значительного времени ничтожно мала — 10% [4]. В данном случае может быть рекомендованаунилатеральнаялимфаденэктомия с последующим тщательным наблюдением. Однако при наличии метастазов более чем в одном лимфатическом узле с одной стороны вероятность возник-новениямикрометастазов с контралатеральной стороны увеличивается до 30% [4, 10]. В данной ситуации показана билатеральная лимфаденэктомия.
Адъювантная терапия
Показана при поражении двух и более лимфатических узлов либо при инвазии опухоли за пределы капсулы лимфатического узла, так как у данной группы больных прогноз значительно ухудшается по сравнению с больными, у которых определяется метастатическое поражение только одного лимфатического узла. Результаты II фазы рандомизированных исследований, проводимых в настоящее время в США и посвящённых данной проблеме, говорят в пользу назначения адъювантной химиотерапии [11, 14].
Комбинированная терапия
Включает химиолучевое воздействие и хирургическое вмешательство. Пациентам с первично диагностированным РПЧ с наличием метастатического поражения тазовых лимфатических узлов показананеоадъювантнаяхимио-терапия. Радикальную или паллиативную операцию либо лучевую терапию проводят с учётом ответа опухоли на химиотерапию. При плохом ответе на химиотерапию паллиативное оперативное лечение может быть применено у выборочной группы больных (соматически сохранные, с большой ожидаемой продолжительностью жизни).
Химиотерапия
Используют как в различных сочетаниях с другими методами, так и в качестве самостоятельного метода лечения, особенно при наличии отдалённых метастазов. Так, химиотерапию комбинируют с лучевым методом при фимозе (после циркумцизии). Её также сочетают с лучевым лечением и криодеструкцией или лазерным воздействием [11, 13].
Адъювантная химиотерапия. Наиболее целесообразны следующие режимы адъювантной химиотерапии.
Цисплатин + фторурацил.
Цисплатин 75–100 мг/м2, внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией в 1-й день.
Фторурацил 750–1000 мг/м2в день внутривенно в виде непрерывной 96-ча-совой инфузии (с 1-го по 4-й день включительно).
Повторные курсы каждые 3–4 нед.
Цисплатин + блеомицин + метотрексат.
Цисплатин 75 мг/м2,внутривенная инфузия со скоростью не более 1 мг/мин. с пред- и постгидратацией в 1-й день.
Блеомицин 10 мг/м2внутривенно в течение 10 мин в 1-й и 8-й дни.
Метотрексат 25 мг/м2внутривенно струйно в 1-й и 8-й дни.
Следующий курс — на 21-й день.
Неоадъювантную химиотерапию назначают по тем же схемам, что и адъювантную.
Самостоятельную химиотерапию при наличии отдалённых метастазов про-водят комбинацией цисплатина с 5-фторурацилом либо используют стандарт-ные схемы воздействия.
Лучевая терапия
Проводят как в самостоятельном варианте, так и в комбинации с другими методами лечения. При комбинации лучевой терапии с оперативным методом облучению подвергают первичный опухолевый очаг, а также зоны пахово-бедренных лимфатических узлов. При отсутствии клинических данных об опухолевом поражении паховых лимфатических узлов и самостоятельном лучевом лечении паховые лимфатические узлы подвергают облучению с отдельных полей при использовании электронных пучков либо включают в единое поле с первичным очагом при дистанционной гамма-терапии.
Алгоритм терапии рака полового члена
Общий алгоритм терапии РПЧ (табл. 3) может быть представлен следующим образом.
- Первичный очаг.
- Стадия Tis — органосохраняющая тактика.
- Стадия Та–1G1–2 — органосохраняющая тактика. У больных с невозможностью проведения динамического наблюдения показана частичная ампутацияВ [8, 22].
- Стадия Т1G3, Т ?2 — частичная или тотальная ампутация либо эмаскуляция в зависимости от локализации и размеров опухоли. Консервативная терапия возможна только у ограниченной выборочной группы больных с обязательным динамическим наблюдением [8].
- Локальный рецидив при консервативной терапии — повторный курс консервативной терапии при отсутствии инвазии опухоли в кавернозные телаВ. При большом рецидиве и наличии инвазии кавернозных тел по-казана частичная или полная ампутация полового члена [17].
- Непальпируемые лимфатические узлы.
- Низкий риск регионарного метастазирования (рТis, рТаG1–G2, рТ1G1) — динамическое наблюдение. Для больных, у которых невозможно провести плановое обследование через фиксированный промежуток времени, показана паховая лимфаденэктомия [4, 22].
- Средний риск регионарного метастазирования (pТ1G2) — при возможности показана радиоизотопная лимфосцинтиграфия с 99mТс с последующей биопсией лимфатических узлов, накопивших радиофармпрепарат. При обнаружении метастатического поражения лимфатических узлов показано их удаление. При невозможности выполнить радиоизотопнуюлимфосцинтиграфию показана паховая лимфаденэктомия. Отказ от паховой лимфаденэктомии возможен только у строго отобранной группы больных с обязательным тщательным динамическим наблюдением.Паховуюлимфаденэктомию необходимо дополнить тазовой при наличии двух и более метастазов в паховых лимфатических узлах или экстракапсулярной инвазии [22, 32].
- Высокий риск регионарного метастазирования (рТ ?2 или G3) — радикальная паховая лимфаденэктомия, которая может быть дополнена тазовой при соответствующих гистологических находках.
- Метастатическое поражение пальпируемых лимфатических узлов.
- Показана радикальная паховая лимфаденэктомия, которая может быть расширена до тазовой при соответствующих гистологических находках. Больным с массивными паховыми конгломератами или с увеличенными тазовыми лимфатическими узлами (по данным КТ и МРТ) показана предоперационная химио- или лучевая терапия. Однако неоадъювантная лучевая терапия статистически достоверно повышает смертность пациентов при последующейлимфаденэктомии. В случае появления лимфатических узлов в процессе динамического наблюдения показано выполнение паховой лимфаденэктомии с возможностью расширения до тазовой при соответствующих гистологических находках [22].
- Отдалённые метастазы.
- Показано проведение химио- или паллиативной терапии (соответственно состоянию и возрасту пациента).
Таблица 3. Алгоритм терапии рака полового члена
| Уровень распространения опухоли | Лечение | Обязательные | Оптимальные |
| Первичная опухоль | Консервативная терапия | Первичная или рецидивная Tis, Ta–1G1–2 | T1G3, Т2, поражающие менее 50% головки |
| Тотальная или частичная ампутация | Первичная или рецидивная T1G3, Т ?2 | Первичная или рецидивная Ta–1G1–2 (консервативная терапия невозможна) | |
| Лучевая терапия | Т1–2 <4 см | ||
| Непальпируемые регионарные лимфатические узлы | Наблюдение | Tis, TaG1–2, Т1G1, Т1G2, поверхностный рост или сосудистый либо отрицательная динамика биопсии сторожевого узла | T1G3, Т2 (при возможности диспансерного наблюдения) |
| Модифицированная лимфаденэктомия | Т1G2 узловой рост или сосудистый либо отрицательная динамика биопсии сторожевого узла, Т1G3 или любая Т2 | Т1G2, сосудистый поверхностный рост или отрицательная динамика биопсии сторожевого узла (при невозможности динамического наблюдения) | |
| Пальпируемые регионарные лимфатические узлы | Радикальная лимфаденэктомия | Положительные узлы при обращении | + Адъювантная химиотерапия или лучевая терапия (более одного положительного узла) |
| Положительные узлы после наблюдения | +Односторонняялимфаденэктомияна стороне положительного узла | ||
| Химиотерапия +/ лимфаденэктомия | Фиксированные паховые конгломераты. Тазовые узлы | ||
| Лучевая терапия +/ лимфаденэктомия | Фиксированные конгломераты (при невозможности проводить химиотерапию) | ||
| Отдалённые метастазы | Химиотерапия или паллиативная терапия (соответственно состоянию и возрасту пациента) |
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
При дальнейшем наблюдении за больным раком полового члена рекомендуют придерживаться следующих алгоритмов (табл. 4).
Первичная опухоль
Пациентов, у которых проведена консервативная терапия, необходимо обследовать каждые 2 мес. в течение первых 2 лет, затем каждые 3 мес. в течение 1 года, затем каждые 6 мес. Больной должен иметь навыки самообследования. Больных, которым выполнена частичная либо тотальная ампутация, обследуют каждые 4 мес. в течение первых 2 лет, затем каждые 6 мес.
Регионарные лимфатические узлы и отдалённые метастазы
- После удаления первичного очага при намеченном динамическом наблюдении показано регулярное обследование каждые 2 мес. в течение первых 2 лет, затем каждые 3 мес. в течение последующего года, затем каждые 6 мес. в последующие 2 года.
- После паховой лимфаденэктомии (рN0) показано контрольное обследование каждые 4 мес. в течение первых 2 лет, затем каждые 3 мес. в течение 1 года. Дальнейшее наблюдение при отсутствии признаков метастазирова-ния можно не проводить.
- После паховой лимфаденэктомии (рN1–3) показано тщательное обследование (КТ малого таза, МРТ, рентгенография грудной клетки, УЗИ органов брюшной полости, малого таза) каждые 2 мес.по меньшей мере в течение 2 лет. Сканирование костей показано только при наличии симптомов поражения костной ткани [4, 10].
ПРОГНОЗ
Зависит от стадии заболевания. При начальных формах заболевания прогноз вполне благоприятный: можно добиться стойкого излечения практически в 100% случаев. При II–III стадии процесса при комбинированном лечении 5-летняя выживаемость больных достигает 60–70%. При IV стадии выживаемость гораздо ниже. Без лечения больные живут в среднем около 3 лет [22, 30, 32].
Таблица 4. Диспансерное наблюдение при раке полового члена [37]
| Уровень распространения опухоли | Лечение |
Интервал |
Обследование | |||
| 1–2-й год | 3-й год | 4–5-й год | Обязательное | Дополнительное | ||
| Первичная опухоль | Органосохраняющее лечение | Каждые 2 мес. | Каждые 3 мес. | Каждые 6 мес. | Физикальное | Цитология или биопсия в неясных случаях |
| Частичная или тотальная пенилэктомия | Каждые 4 мес. | Каждые 6 мес. | Каждые 12 мес. | Физикальное | ||
| Регионарные метастазы | Наблюдение | Каждые 2 мес. | Каждые3 мес. | Каждые 6 мес. | Физикальное | Цитология или биопсия в неясных случаях |
| Лимфаденэктомия | Каждые 4 мес. | Каждые 6 мес. | Каждые12 мес. | Физикальное,УЗИ брюшной полости, таза. Рентгенография грудной клетки | Остеосцинтиграфия. КТ таза | |
Литература
- Akduman B., Fleshner N. E., Ehrlich L., Klotz L. Early experience in intermediate-risk penile cancer with sentinel node id entification using the gamma probe // Urology. — 2001. — Vol. 58. — Р. 65–68.
- Bezerra A. L., Lopes A., Landman G. et al.Clinicopathologic features and human papillomavirus DNA prevalence of warty and squamous cell carcinoma of the penis // Am. J. Surg. Pathol. — 2001. — Vol. 25. — Р. 673–678.
- Burgers J. K., Badalament R. A., Drago J. R. Penile cancer: clinical presentation, diagnosis and staging // Urol. Clin. North. Am. — 1992. — Vol. 19. — Р. 247–256.
- Colberg J. W., Andriole G. L., Catalona W. J. Long-term follow-up of men undergoing modified inguinal lymphadenectomy for carcinoma of the penis // B. J. U. — 1997. — Vol. 79. — Р. 54–57.
- Crook J., Grimard L., Tsihlias J. et al. Interstitial brachytherapy for penile cancer: an alternative to amputation // J. Urol. — 2002. — Vol. 167. — Р. 506–511.
- Culkin D. J., Beer T. M. Advanced penile carcinoma // J. Urol. — 2003. — Vol. 170. — Р. 359–365.
- d’Ancona C. A., de Lucena R. G., Querne F. A., Martins M. H. et al. Long-term follow-up of penile carcinoma treated with penectomy and bilateral modified inguinal lymphadenectomy // J. Urol.— 2004. — Vol. 172. — Р. 498–501.
- Davis J. W., Schellhammer P. F., Schlossberg S. M. Conservative surgical therapy for penile and urethral carcinoma // Urology. — 1999. — Vol. 53. — Р. 386–392.
- Demkow T. The treatment of penile carcinoma: experience in 64 cases // Int. Urol. Nephrol. — 1999. — Vol. 31. — Р. 525–531.
- Derakshani P., Neubauer S., Braun M. et al. Results and 10-year follow-up in patients with squamous cell carcinoma of the penis // Urol. Int. — 1999. — Vol. 62. — Р. 238–244.
- Dexeus F. H., Logothetis C. J., Sella A. et al. Combination chemotherapy with methotrexate, bleomycin and cisplatin for advanced squamous cell carcinoma of the male genital tract // J. Urol. — 1991. — Vol. 146. — Р. 1284–1287.
- Dillner J., von Krogh G., Horenblas S., Me?er C. J. Etiology of squamous cell carcinoma of the penis // Scand. J. Urol. Nephrol. — 2000. — Vol. 205 (Suppl.). — Р. 189–193.
- Eisenberger M. A. Chemotherapy for carcinoma of the penis and urethra // Urol. Clin. North. Am. — 1992. — Vol. 19. — Р. 333–338.
- Fisher H. A., Barada J. H., Horton J.Neoadjuvant therapy with cisplatin and 5-fl uorouracil for stage III squamous cell carcinoma of the penis // ActaOncol. — 1990. — Vol. 27A. — Р. 653 (abstract 352A).
- Frimberger D., Hungerhuber E., Zaak D. et al. Penile carcinoma. Is Nd: YAG laser therapy radical enough // J. Urol. — 2002. — Vol. 168. — Р. 2418–2421.
- Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penile. Part 2: the role and technique of lymph node dissection // B. J.U. Int. — 2001. — Vol. 88. — Р. 473–483.
- Koch M. O., Smith J. A. Jr. Local recurrence of squamous cell carcinoma of the penis // Urol. Clin. North. Am. — 1994. — Vol. 21. — Р. 739–743.
- Laniado M. E., Lowdell C., Mitchell H., Christmas T. J. Squamous cell carcinoma antigen: a role in the early identification of nodal metastases in men with squamous cell carcinoma of the penis // B. J.U. Int. — 2003. — Vol. 92. — Р. 248–250.
- Mahlmann B., Doehn C., Feyerabend T.Radiochemotherapy of penis carcinoma // Urologie. — 2001. — Vol. 40. — Р. 308–312.
- Maiche A. G., Pyrhonen S., Karkinen M. Histological grading of squamous cell carcinoma of the penis: a new score system // Br. J. Urol. — 1991. — Vol. 67. — Р. 522–526.
- Montie J. E. Follow-up after penectomy for penile carcinoma // Urol. Clin. North. Am. — 1994. — Vol. 21. — Р. 725–727.
- Ornellas A. A., Seixas A. L. C., Marota A. et al. Surgical treatment of invasive squamous cell carcinoma of the penis: retrospective analysis of 350 cases // J. Urol. — 1994. — Vol. 151. — Р. 1244–1249.
- Pettaway C. A., Pisters L. L., Dinney C. P. N. et al. Sentinel lymph node dissection for penile carcinoma: the M. D. Anderson Cancer Center Experience // J. Urol. — 1995. — Vol. 154. — Р. 1999–2003.
- Ravi R. Correlation between the extent of nodal involvement and survival following groin dissection for carcinoma of the penis // Br. J. Urol. — 1993. — Vol. 72. — Р. 817–819.
- Sarin R., Norman A. R., Steel G. G., Horwich A.Treatment results and prognostic factors in 101 men treated for squamous carcinoma of the penis // Int. J. Radiat. Oncol. Biol. Phys. — 1997. — Vol. 38. — Р. 713–722.
- Senthil Kumar M. P., Ananthakrishnan N., Prema V. Predicting regional node metastasis in carcinoma of the penis: a comparison between fi ne-needle aspiration cytology, sentinel lymph node biopsy and medial inguinal lymph node biopsy // B. J.U. — 1998. — Vol. 81. — Р. 453–457.
- Skoog I., Collins B. T., Tani E., Ramos R. R. Fine-needle aspiration cytology of penile tumors // ActaCytol. — 1998. — Vol. 42. — Р. 1336–1340.
- Slaton J. W., Morgenstern N., Levy D. A. et al. Tumor stage, vascular invasion and the percentage of poorly diff erentiated cancer: independent prognosticators for inguinal lymph node metastasis in penile squamous cancer // J. Urol. — 2001. — Vol. 165. — Р. 1138–1142.
- Sobin L. H., Wittekind Ch. TNM Classification of Malignant Tumors. — 6th ed. — New York: Wiley-Liss, 2002.
- Solsona E., Agaba F., Horenblas S. et al. Guidelines on penile cancer // Recomendations of European Association of Urology. — 2004.
- Solsona E., Iborra I., Ricуs J. V. et al. Corpus cavernosum invasion and tumor grade in the prediction of lymph node condition in penile carcinoma // Eur. Urol. — 1992. — Vol. 22. — Р. 115–118.
- Solsona E., Iborra I., Rubio J. et al. Prospective validation of the association of local tumor stage grade as a predictive factor for occult lymph node microme-tastasis in patients with penile carcinoma and clinically negative inguinal lymph nodes // J. Urol. — 2001. — Vol. 165. — Р. 1506–1509.
- Soria J. C., Fizazi K., Piron D. et al. Squamous cell carcinoma of the penis: multivariate analysis prognostic factors and natural history in monocentric study with a conservative policy // Ann. Oncol. — 1997. — Vol. 8. — Р. 1089–1098.
- Stancik I., Holtl W. Penile cancer: A review of the recent literature // Curr. Opin. Urol. — 2003. — Vol. 13. — Р. 467–472.
- Tanis P. J., Lont A. P., Meinhardt W. et al. Dynamic sentinel node biopsy for penile cancer: reliability of a staging technique // J. Urol. — 2002. — Vol. 168. — Р. 76–80.
- Zouhair A., Coucke P. A., Jeanneret W. et al.Radiation therapy alone or combined surgery and radiation therapy in squamous cell carcinoma of the penis // Eur. J. Cancer. — 2001. — Vol. 37. — Р. 198–203.
- Guidelines European Association of Urology. — 2008. — P. 58–69.