 Применение толтеродина пациентками с рецидивирующим хроническим циститом
Применение толтеродина пациентками с рецидивирующим хроническим циститом
Введение. Симптомы заболеваний нижних мочевыводящих путей (СНМП), обусловленные рецидивирующим хроническим воспалением мочевого пузыря, представляют большую социально-экономическую проблему.
В современной литературе нет единого мнения, что первично: воспалительный процесс в мочевом пузыре или функциональные расстройства акта мочеиспускания, характеризующиеся обструктивной и/или ирритативной симптоматикой [1].
Персистенция микроорганизмов, их высокая выживаемость и резистентность – одна из причин, поддерживающая СНМП. Они могут длительно сохраняться и значительно снижать качество жизни пациенток с рецидивирующим хроническим инфекционно-воспалительным процессом в стенке мочевого пузыря даже после эрадикации возбудителя, что требует поиска новых эффективных методов лечения. По оценкам B. Foxmana, рецидив инфекции нижних мочевыводящих путей наблюдается в течение 6 мес у 20– 27% пациенток [2].
Распространенность рецидивирующих инфекций мочевыводящих путей зависит от возраста и пола [3]. К факторам риска развития рецидива хронического цистита у женщин относят наличие у них анатомических и функциональных нарушений, использование спермицидов, смену сексуальных партнеров, наличие инфекции мочевыводящих путей в детском возрасте, а также рецидивирующее течение инфекционно-воспалительного процесса в мочевом пузыре у матери и мн. др. [4, 5].
Обострение хронического цистита в постменопаузе развивается на фоне неудержания мочи, цистоцеле, остаточной мочи, может быть обусловлено атрофическим вагинитом и изменениями защитных свойств уротелия за счет снижения уровня эстрогенов [6, 7]. Уротелий – это не только обычная защита против инфекций мочевого пузыря, это особенная ткань, регулирующая его функцию и играющая роль в патогенезе других заболеваний. Существуют доказательства, что в развитии хронических воспалительных заболеваний мочевого пузыря первой ступенью может быть потеря гликозаминогликанов слизистого слоя с последующим нарушением функции органа, проявляющимся повышенной сократительной функцией детрузора [8, 9].
При хроническом воспалении слизистой мочевого пузыря в ней обнаруживаются дефекты в виде расширения просветов между клетками эпителия, что, возможно, связано с изменениями гликозаминогликанового слоя. В результате микротравм защитного слоя раздражающие химические вещества, содержащиеся в моче, могут воздействовать на нервные волокна подслизистого слоя, вызывая нейрогенное воспаление, тем самым поддерживая ирритативные симптомы [9, 10].
Предполагают, что длительный хронический воспалительный процесс в стенке мочевого пузыря может приводить к развитию в ней хронической субэпителиальной ишемии и гипоксии, которые в одно и то же время повреждают эпителий, снижая его регенераторную способность, и нарушают его функцию [11, 12]. M. Nomiya и соавт. [12] в эксперименте на животных с хронической ишемией мочевого пузыря зафиксировали увеличение уровня маркера оксидативного стресса малонового диальдегида и провоспалительных цитокинов (IL-6, -8,TNF-?) по сравнению с контролем, которые, по мнению авторов, могут быть ключевыми факторами в развитии дисфункции этого органа.
Воздействуя на определенные рецепторы, биологически активные вещества способствуют развитию патологической повышенной чувствительности мочевого пузыря, сокращению его гладкой мускулатуры за счет раздражения С-волокон. Особенностью иннервации является наличие в области шейки мочевого пузыря сплетений чувствительных волокон, расположенных под уротелием. Повреждения последних, по всей видимости, при рецидивирующих инфекционновоспалительных процессах приводят к гиперчувствительности мочевого пузыря и развитию гипер-активности, что поддерживает воспаление в стенке мочевого пузыря и обеспечивает сохранение СНМП [11, 13, 14].
В некоторых сообщениях указано, что на фоне хронического инфекционно-воспалительного процесса уротелий мочевого пузыря начинает вырабатывать простагландины, фактор роста нервов, оксид азота и “чувствительные” к рецепторам молекулы: брадикинин, нейротропин, норэпинефрин, пурины (P2X и P2Y), ацетилхолин (никотиновые и мускариновые рецепторы) [15]. Таким образом, увеличение уровня биологически активных веществ в моче воздействует на рецепторы мочевого пузыря, поддерживая воспалительный процесс в его стенке и гиперактивность [16].
Мускариновые рецепторы играют важную роль как в реализации нормального акта мочеиспускания, так и при развитии патологического процесса в мочевом пузыре [17]. Экспериментальные данные, полученные рядом исследователей, подтверждают, что в уротелии мочевого пузыря число мускариновых рецепторов в 2 раза больше, чем в гладких мышцах детрузора [18, 19].
Средствами, блокирующими действие ацетилхолина на М-холинорецепторы мочевого пузыря, увеличивающими накопительную способность и снижающими ургентность, что крайне важно для пациенток с хроническим воспалительным процессом в мочевом пузыре, являются антимускариновые препараты. Известно, что постсинаптические мембраны рецепторов стенки мочевого пузыря служат точкой приложения М-холинолитиков.
На сегодняшний день во многих странах мира самый востребованный препарат этой группы – толтеродин. Международная программа клинических исследований толтеродина является одной из самых обширных [20, 21]. В 1997 г. в зарубежной печати появились сведения о первых доклинических результатах применения толтеродина. Впервые в эксперименте на животных была продемонстрирована его избирательность в отношении рецепторов мочевого пузыря [20]. Выраженное влияние толтеродина на функцию мочевого пузыря было подтверждено на здоровых добровольцах. Применение препарата в дозировке от 1 до 2 мг приводило к снижению частоты мочеиспусканий, эпизодов неудержания мочи, увеличению объема мочеиспускания [21].
Роль антимускариновых препаратов при лечении СНМП, связанных с обострением хронического цистита, еще недостаточно изучена, хотя в литературе отечественные и зарубежные авторы отмечают эффективность М-холинолитиков и рекомендуют эти препараты в периоды активности процесса в мочевом пузыре и выраженной ургентности [7]. Целью нашей работы явилось изучение влияния М-холиноблокатора толтеродина на качество жизни пациенток с рецидивирующим хроническим циститом.
Материалы и методы. В 2011 г. амбулаторно и стационарно обследованы 82 пациентки с рецидивирующим хроническим циститом в возрасте 45–60 лет. Пациентки обратились в клинику с жалобами на частые болезненные мочеиспускания малыми порциями, боли или дискомфорт внизу живота, императивные позывы на мочеиспускание. Длительность хронического цистита составила от 5 до 9 лет.
Все пациентки прошли полное урологическое и гинекологическое обследование: общий анализ мочи и ее микробиологическое исследование на наличие возбудителя с определением чувствительности к антибактериальным препаратам; клинический и биохимический анализы крови; коагулограмму; ультразвуковое обследование органов мочевой и половой систем; урофлоуметрию с определением объема остаточной мочи. Осмотр неврологом, рентгенологическое исследование мочевой системы, уродинамическое исследование проводились по показаниям. Проведен письменный опрос с помощью анкет: дневник мочеиспусканий в течение 3 сут, шкала качества жизни (QoL), индекс женской сексуальной функции (ИЖСФ), госпитальная шкала тревоги и депрессии (HADS).
Критерии включения: женщины в возрасте от 45 до 65 лет, наличие симптомов учащенного болезненного мочеиспускания более 8 раз в сутки, боли/дискомфорта внизу живота и/или уретре, императивных позывов на мочеиспускание, наличие хронического цистита более года, подтвержденного результатами морфологического исследования биоптатов слизистой мочевого пузыря; содержание патогенного возбудителя в моче более 103 КОЕ/мл, лейкоцитурия; индекс QoL 4 и более баллов.
Критерии исключения: объемные образования мочевого пузыря, нейрогенный мочевой пузырь, макрогематурия, наличие остаточной мочи, обструктивный тип мочеиспускания, камни мочевого пузыря, лучевые и радиационные циститы, иммунодефицитные состояния и наличие генитальных инфекций, а также глаукома, миастения, язвенный колит, мегаколон, декомпенсированный сахарный диабет, запоры, оперативные вмешательства на органах малого таза, нейропатии, неудержание мочи.
По итогам обследования в исследование включены 47 пациенток с хроническим рецидивирующим циститом в стадии обострения с необструктивным типом мочеиспускания. От всех этих пациенток было получено письменное информированное согласие. В зависимости от проводимой терапии больные были разделены на 2 группы. В 1-ю группу вошли 23 женщины в возрасте от 45 до 56 лет, получавшие толтеродин (уротол, Zentiva) на фоне антибактериальной терапии с учетом чувствительности выделенного штамма. Двадцать четыре пациентки в возрасте от 45 до 60 лет составили 2-ю, контрольную, группу и получали стандартную антибактериальную терапию также с учетом чувствительности возбудителя и спазмолитики. Группы были практически однородными и не различались по основным характеристикам.
Длительность антибактериальной терапии составила 7 дней в обеих группах с последующим микробиологическим контролем лечения. Толтеродин принимали в дозе 2 мг 2 раза в сутки. Препарат был назначен сроком на 1 мес как симптоматическая терапия, направленная на уменьшение СНМП.
Эффективность симптоматической терапии толтеродином по сравнению со стандартной терапией оценивали на 14-е и 30-е сут лечения, что соответствовало “конечным точкам исследования” по следующим критериям: клиническая эффективность, безопасность применения толтеродина для пациенток с рецидивирующим хроническим циститом.
Статистическую обработку результатов проводили с использованием программы “Биостат”. Применялись критерии Стьюдента и Вилкоксона. Результаты и обсуждение. Данные, полученные в ходе исследования, демонстрировали приоритет Escherichia coli как возбудителя мочевой инфекции нижних мочевыводящих путей в обеих группах.
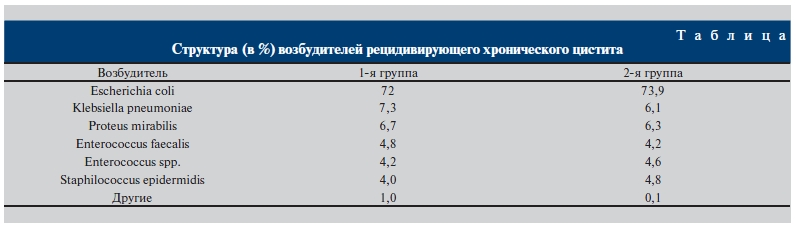 Большую долю составили и другие представители семейства Enterobacterioceae, а также грамположительной флоры (см. таблицу).
Большую долю составили и другие представители семейства Enterobacterioceae, а также грамположительной флоры (см. таблицу).
Структура (в %) возбудителей рецидивирующего хронического цистита.
После проведенного курса антибактериальными препаратами эрадикация возбудителя наступила в 90,5 и 87,5% наблюдений в 1-й и 2-й группах соответственно. Бактериологический эффект не был достигнут всего для 5 (10,6%) пациенток: у 2 (9,5%) пациенток 1-й группы и 3 (12,5%) – 2-й при контрольном микробиологическом исследовании мочи выявлен тот же возбудитель в значительно меньшем титре, что потребовало продолжения терапии и повторного обследования. Эти пациентки были исключены из дальнейшего исследования.
Последние данные исследований уропатогенных микроорганизмов с использованием современного молекулярного метода – электрофореза в пульсирующем поле (PFGE – Pulsed Field gel Electrophoresis) показали, что 77% рецидивирующих инфекций мочевыводящих путей были вызваны одним и тем же штаммом, чаще – Е.coli. Этот факт подтверждает наблюдение, что Е.coli, реплицируясь в стенке мочевого пузыря, может формировать внеклеточные бактериальные сообщества, которые являются устойчивыми резервуарами, способствуя персистенции инфекционного процесса и СНМП. Нередко возбудители инфекции длительно пребывают в латентном (“дремлющем”) состоянии либо при неблагоприятном состоянии макроорганизма обретают способность реактивироваться с появлением новых клинических доминант. Наличие генных факторов патогенности, биофильмов, плазмид, резистентности к антибактериальным препаратам приводит к персистенции инфекционно-воспалительного процесса и ирритативным симптомам [22].
Несмотря на эрадикацию возбудителя, клинический эффект наблюдался не у всех пациенток. У 52,6 % пациенток 1-й группы положительная динамика наметилась через 3 дня от начала терапии. В обеих группах были отмечены нормализация акта мочеиспускания, купирование императивных позывов на мочеиспускание; увеличение среднего объема мочеиспусканий по сравнению с исходным в 1-й группе у 78,9 и 84,2%, а во 2-й – у 66,6 и 71,4% пациенток через 14 и 30 дней лечения соответственно. Частота мочеиспусканий достоверно снизилась в 1-й группе с 17,3±3,8 (12–23) до 7,3±1,8 (5–10) и 8,5±1,3 (6–10) , во 2-й – с 18,6±4,5 (12-25) до 9,3 ±2,2 (7–12) и 8,6±2,3 (6–11) через 2 нед и 1 мес терапии соответственно. Увеличился средний объем мочеиспускания в миллилитрах – с 83,4 ±21,3 (50–120) до 265,7±61,6 (170–300) и 293,7±78,4 (220–370) в 1-й группе в те же сроки. Во 2-й группе также отмечено нарастание данного показателя с 81,2±19,6 (50–110) до 215,7±42,6 (160–250) и 273,6±92,3 (150–320) за время динамического наблюдения.
В 1-й и 2-й группах соответственно у 3 (15,8%) и 7 (33,3%) пациенток на фоне бактериологического эффекта практически отсутствовал клинический эффект, т. е. сохранялись выраженные СНМП через 30 дней лечения. Им было проведено дополнительное обследование в объеме комплексного уродинамического исследования, которое выявило детрузорную гиперактивность у 2 (10,5%) и 5 (23,8%) пациенток в 1-й и 2-й группах соответственно, что потребовало продолжения лечения толтеродином. У 1 (5,3%) и 2 (9,5%) пациенток соответствующих групп при сохраняющихся симптомах изменений уродинамических показателей отмечено не было.
По данным ретроспективного исследования известно, что у 36,8–44% пациенток, которые имеют СНМП при уродинамическом обследовании, не выявляется гиперактивность детрузора [23]. Таким образом, отсутствие уродинамически подтвержденных нарушений функции мочевого пузыря и отсутствие эффекта от лечения толтеродином могут говорить либо о недостоверности результатов уродинамического исследования, либо о вовлечении в воспалительный или дистрофический процесс других рецепторов уротелия и необходимости проведения новых исследований [13].
Качество жизни пациенток, страдающих рецидивирующим хроническим циститом, низкое [7, 23]. Пациентки отмечали необходимость прерывания рабочего дня из-за частого посещения туалета, что было связано с симптомами заболевания.
Оценка данных шкалы качества жизни пациенток с рецидивирующим хроническим циститом, принимавших толтеродин, показала достоверные улучшения с 5,2±0,1 до 2,3±0,8 по сравнению с контрольной группой – с 5,0±0,67 до 2,8±0,73.
Таким образом, применение М-холинолитиков в группе пациенток с рецидивирующим хроническим циститом способствовало повышению качества их жизни на 24,2% по сравнению с группой контроля за счет купирования ирритативных и ургентных симптомов. По данным шкалы тревоги и депрессии до лечения выявлена субклиническая форма тревоги у 8 (38%) респонденток 1-й группы и у 7 (21,2%) – 2-й. Через 4 нед лечения отмечено уменьшение тревожной симптоматики в обеих группах. Средний балл тревоги имел тенденцию к уменьшению с 7,2±0,3 до 6,6±0,5 и с 6,9±0,8 до 6,1±0,4 в 1-й и 2-й группах соответственно.
Пациентки с рецидивирующим хроническим циститом часто воздерживаются от половой жизни, боясь обострения заболевания. Анализ данных опроса пациенток по ИЖСФ показал, что сексуальная реабилитация женщин с рецидивирующим хроническим циститом через 1 мес терапии отмечена у 26,3% женщин в 1-й группе и в 14,3% – во 2-й.
В возникновении обострений хронического цистита нельзя исключать роль нервно-психического фактора, который может вызывать функциональные расстройства мочеиспускания. Экспериментально доказано участие вегетативной нервной системы в патогенезе местных изменений в мочевом пузыре. Длительные эмоциональные переживания, отрицательные эмоции, стрессы, нервное перевозбуждение, сексуальные конфликтымогут приводить к возникновению функциональных расстройств мочеиспускания и развитию инфекционного цистита [1].
Таким образом, качество жизни пациенток, психосоматическое состояние, сексуальная реабилитация характеризовались лучшими показателями в 1-й группе по сравнению с контрольной, что, по всей видимости, связано с более быстрой нормализацией функции мочевого пузыря на фоне приема толтеродина.
В исследовании отмечена хорошая переносимость толтеродина, его безопасность. Аллергических реакций за время наблюдения отмечено не было. Наличие остаточной мочи у пациенток не зафиксировано. Трем пациенткам доза была снижена до 1 мг 2 раза в сутки. Две пациентки выбыли из исследования в связи с жалобами на головокружение и сухость во рту, что послужило основанием для отмены препарата.
Заключение. Применение толтеродина в качестве симптоматической терапии при комбинированном лечении пациенток с рецидивирующим хроническим циститом позволяет сократить сроки их реабилитации. Терапия толтеродином показала клиническую эффективность для 85,7% женщин, способствовала улучшению качества жизни на 24,8% по сравнению с контрольной группой, в короткие сроки обеспечивала купирование ургентной, ирритативной симптоматики.
Авторы: Максимов В.А., Ходырева Л.А., Дударева А.А. ГБУЗ Городская клиническая урологическая больница № 47 Департамента здравоохранения г. Москвы
Литература
1. Скрябин Г.Н., Александров В.П., Кореньков Д.Г. Циститы. СПб., МАПО, 2006.
2. Foxman B., Somsel P., Tallman P., Gillespie B., Raz R. et al. Urinary tract infection among women aged 40 to 65: behaviorial and sexual risk factors. J. Clin. Epidimiol., 2001;54(7):710–718.
3. Hooton T.M. Reccurent urinary tract infection in women. Int. J. Antimicrob. Agents. 2001; 17(4):259–268.
4. Lundstredt A. C. et al. Inherited susceptibility to acute pyelonephritis: a family study of urinary tract infection. J. Infect Dis. 2007;195(8):
1227–1234.
5. Hooton T.M. Reccurent urinary tract infection in women. Int. J. Antimicrob. Agents. 2001; 17(4):259–268.
6. Nicolle L.A. Asimptomatic bacteriuria in the elderly. Infect. Dis. Clin. North. Am. 1997; 11(3): 647–662.
7. Суфияров А.Д. Актуальные проблемы консервативной урологии. Менопаузальный цистит. Цисталгия. Под ред. Р. Х. Галеева. Казань: МЕДДОК, 2007. 128 с.
8. Damiano R., Cicione A. The role of sodium hyaluronate and sodium chondroitin sulphate in the management of bladder disease. Adv. Urol. 2011; 3(5): 223–232.
9. Geppetti P., Nassini R., Materazzi S., Benemei S. The concept of neurogenic inflammation. BJU Int. 2008; 101(Suppl.3):2–6.
10. Parsons C.L., Lilly J.D., Stein P. Epithelial dysfunction in nonbacterial cystitis (interstitial cystitis). J. Urol. 1991; 145(4):732–735.
11. Siracusano S., Cucchi S., Ciciliato S. et al Urinary levels of giycosaminoglycans in patients with idiopathic detrusor overactivity. Int Urogynecol J Pelvic Floor Dysfunct. 2009;20(12):1477–1480.
12. Nomiya M., Sagawa K., Yazaki J. et al. Increased bladder activity is associated with elevated oxidative stress markers and proinflammatory cytokines in a rat model of atherosclerosis-induced chronic bladder ischemia. Neurourol. Urodyn. 2012;31(1):185–189.
13. Avelino A., Cruz C., Nagy I. et al. Vanilloid receptor expression in the rat urinary tract. Neuroscience. 2002; 109 (4):787–798.
14. Arya L. A. et al. Evidence of bladder oversensitivity in the absence of an infection in premenopausal women with a history of recurrent urinary tract infections. BJU Int. 2011;30:1464–410.
15. Nile C.J., Gillespie J.I. Interactions between cholinergic and prostaglandin signaling elements in the urothelium: role for muscarinic type 2 receptors. Urology. 2012;79(1):240.
16. Tyagi P., Barclay D., Zamora R. et al. Urine cytokines suggest an inflammatory response in the overactive bladder: a pilot study. Int. Urol. Nephrol. 2010;42(3):629–635.
17. Groat W.C., Yoshimura N. Afferent nerve regulation of bladder function in health and disease. Handb. Exp. Pharmacol. 2009; (194):91–138.
18. Hawthorn M.H., Chapple C.R., Cock M. et al. Urothelium-derived inhibitory factor(s) influences on detrusor muscle contractility in vitro. Br. J. Pharmacol. 2000;129(3):416–419.
19. Mukerji G., Yiangou Y., Grogono J., et al. Localization of M2 and M3 muscarinic receptors in human bladder disorders and their clinical correlations. J. Urol. 2006;176(1):367–373.
20. Nilvebrant L., Andersson K.E., Gillberg P.G. et al. Tolterodine-a new bladder-selective antimuscarinic agent. Eur. J. Pharmacol. 1997; 327(2–3): 195–207.
21. Appell R.A., Abrams P., et al. Treatment of overactive bladder: long-term tolerability and efficacy of tolterodine. World J. Urol. 2001; 19: 141–147.
22. Ejernaes K. Bacterial characteristics of impotance for recurrent urinary tract infections caused by Escherichia coli. Dan Med Bull. 2011; 58(4): В4187.
23. Sellers D.J., McKay N. Developments in the pharmacotherapy of the overactive bladder. Cur Opt Urol. 2007;17(4):223–230.