На сегодняшний день доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из наиболее распространенных заболеваний среди мужчин пожилого и старческого возраста, приводящим к инфравезикальной обструкции и развитию симптомов нижних мочевых путей [1–4]. По данным европейской и североамериканской статистики, частота встречаемости ДГПЖ среди мужчин в возрасте 60 лет составляет 60%, среди пациентов 80 лет и старше – 80% [4, 5]. По данным ряда эпидемиологических исследований, рост заболеваемости ДГПЖ отмечается практически во всех странах, что обусловлено старением населения, а также увеличением обращаемости мужчин и выявляемости заболевания [3].
На сегодняшний день доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из наиболее распространенных заболеваний среди мужчин пожилого и старческого возраста, приводящим к инфравезикальной обструкции и развитию симптомов нижних мочевых путей [1–4]. По данным европейской и североамериканской статистики, частота встречаемости ДГПЖ среди мужчин в возрасте 60 лет составляет 60%, среди пациентов 80 лет и старше – 80% [4, 5]. По данным ряда эпидемиологических исследований, рост заболеваемости ДГПЖ отмечается практически во всех странах, что обусловлено старением населения, а также увеличением обращаемости мужчин и выявляемости заболевания [3].
Вышеназванные факторы свидетельствуют о том, что эффективное лечение доброкачественной гиперплазии предстательной железы представляет собой не только серьезную медицинскую, но и социальную проблему. Следует отметить, что, несмотря на стремительное развитие и все более широкое применение медикаментозной терапии, а также на успехи, достигнутые при применении других малоинвазивных методов, хирургическое лечение больных гиперплазией предстательной железы остается одним из основных направлений терапии данного заболевания. Это делает актуальным вопрос разработки все более совершенных методов оперативного лечения больных ДГПЖ [6, 7].
«Золотым стандартом» хирургического лечения инфравезикальной обструкции, обусловленной доброкачественной гиперплазией простаты, до последнего времени считалась трансуретральная резекция предстательной железы (ТУР), пришедшая на смену открытой аденомэктомии [1, 8–10]. Традиционно лечение с помощью ТУР применяли при относительно небольшом объеме железы – до 90 см³. Однако по мере совершенствования трансуретральной хирургии этот метод стал применяться для удаления крупных желез – до 100–120 см³ (при этом обязательным условием является достаточный опыт хирурга). Однако ТУР практически не применима при объеме железы 150 см³ и более вследствие высокого риска развития интраоперационных осложнений (кровотечения, развития ТУР-синдрома и др.), частота которых возрастает с увеличением объема гиперплазированной ткани, подвергаемой электрорезекции [4, 5, 8, 11, 12].
В этой связи не прекращается поиск новых, минимально инвазивных методик, которые не уступали бы по эффективности ТУР, но позволили бы уменьшить число осложнений и неудач последней. Трансуретральная микроволновая терапия, трансуретральная игольчатая абляция, а также введение этилового алкоголя и ботокса в предстательную железу не нашли широкого применения в силу либо недостаточной эффективности, либо неблагоприятного профиля осложнений [1, 2, 13]. Наибольшее развитие и применение в настоящее время получили различные хирургические вмешательства с применением лазера [14–18]. В последнее время в зарубежной литературе проявляется все больший интерес к новой методике лечения больных гиперплазией предстательной железы – трансуретральной энуклеации простаты с использованием гольмиевого лазера (holmium laser enucleation of the prostate, HoLEP) [19–24].
Преимущества трансуретральной энуклеации простаты с использованием гольмиевого лазера
Гольмиевый лазер принадлежит к семейству твердотельных лазеров, работающих в импульсном режиме в среднем инфракрасном диапазоне, с длиной волны 2,1 микрон. К основным достоинствам гольмиевого лазера можно отнести следующие. Во-первых, сильное поглощение в биоткани, в то же время хорошая передача излучения через кварцевое волокно. Кварцевое стекло прозрачно для длины волны излучения гольмиевого лазера, что дает возможность использовать тонкое гибкое кварцевое оптическое волокно для доставки излучения гольмиевого лазера к объекту воздействия.
Во-вторых, высокая пиковая мощность (> 4 кВт), создаваемая за счет импульсного режима, что приводит к сильному испарению (абляции) биоткани. Глубина проникновения одного импульса мала (0,4 мм), причем она практически не зависит от васкуляризации ткани. Соответственно, отсутствуют сильный некроз, карбонизация и ожог ткани вокруг лазерной раны.
В-третьих, возможность рассечения тканей в контакте и коагуляция в бесконтактном режиме работы. Кончик волокна не нагревается, не пригорает и самоочищается под действием излучения 2,09 мкм. Гемостаз возникает за счет скручивания капилляров, что уменьшает вероятность образования и отрыва крупных тромбов. Остановка кровотечения гольмиевым лазером за счет коагуляции биоткани имеет ряд преимуществ. Обычно механизм коагуляции различными хирургическими аппаратами осуществляется за счет термического воздействия – сильный нагрев биоткани приводит к вскипанию крови и образованию микротромбов в капиллярах. Излучение гольмиевого лазера в основном испаряет кровь, а сосуды скручиваются без заметного образования тромбов, что снижает вероятность вторичного кровотечения из-за их механического отрыва.
В-четвертых, при заживлении раны от лазера рубцевание ткани минимально. Благодаря своей многофункциональности и широкому спектру применения, гольмиевый лазер называют «швейцарским армейским ножом» среди лазеров [16, 18].
В 1996 г. P.J. Gilling и соавт. [25, 26] впервые описали гольмиевую лазерную резекцию простаты (holmium laser resection of the prostate, HoLRP). Эта техника предусматривала использование режущих свойств гольмиевого лазера для удаления крупных долей аденоматозной ткани. Главным достоинством такой операции была возможность использования обычного физиологического раствора в качестве ирригационной жидкости, что исключало развитие ТУР-синдрома. Во время HoLRP сначала удаляется средняя доля, а затем боковые. Поскольку ткань необходимо извлечь эндоскопическим путем, доли простаты делятся на несколько частей, которые затем легко удалить. Небольшие фрагменты извлекаются из мочевого пузыря специальной петлей через тубус резектоскопа, а более мелкие фрагменты ткани могут быть удалены с помощью эвакуатора Эллика.
Многие клинические центры опубликовали результаты достаточно удачного применения HoLRP: случаев гемотрасфузии либо возникновения гипонатриемии зафиксировано не было. При рандомизированном сравнении результатов проведения HoLRP и ТУР [27], а также состояния пациентов в течение двух лет после операции не было отмечено значительных расхождений по шкале Американской урологической ассоциации (AUA SS), качеству жизни и максимальной скорости мочеиспускания. Единственное различие заключалось в значительно более длительном периоде катетеризации и нахождении в стационаре пациентов, которым была выполнена ТУР.
Одним из недостатков HoLRP остается длительность проведения манипуляции, в этом отношении ТУР имеет преимущество. Значительно увеличивает длительность лазерной резекции процесс извлечения удаленной ткани, так как размер удаляемых фрагментов ограничен размером уретры.
Для преодоления трудностей, возникавших при проведении HoLRP, был создан образец трансуретрального морцеллятора [27, 28]. Стало возможным изменение техники проведения резекции путем осуществления морцелляции удаленной ткани внутри мочевого пузыря. Это позволяет полностью извлечь среднюю и боковые доли простаты из мочевого пузыря, не прибегая к длительному процессу деления удаленной ткани на более мелкие части. В результате стало возможным достичь скорости удаления ткани, сравнимой с таковой при открытой аденомэктомии, при этом манипуляция остается минимально инвазивной. В сущности, последней модификацией лазерной резекции является гольмиевая лазерная энуклеация простаты (HoLEP), которая совмещается с механической морцелляцией [29].
Методика выполнения трансуретральной гольмиевой энуклеации простаты
Классической считается техника, предложенная P.J. Gilling. В основе этой методики лежит последовательная энуклеация долей доброкачественной гиперплазии простаты с последующим удалением ее из мочевого пузыря.
После стандартной обработки наружных половых органов раствором антисептика (1% раствор йодопирона) в мочевой пузырь по уретре проводится эндоскоп. С целью атравматичного проведения инструмента и снижения риска развития в последующем стриктуры уретры в обязательном порядке используются любриканты (Катеджель, Инстиллагель). Операцию начинают с тщательного осмотра мочевого пузыря, области устьев мочеточников, предстательной железы, определяют ориентиры зоны вмешательства (рис. 1).
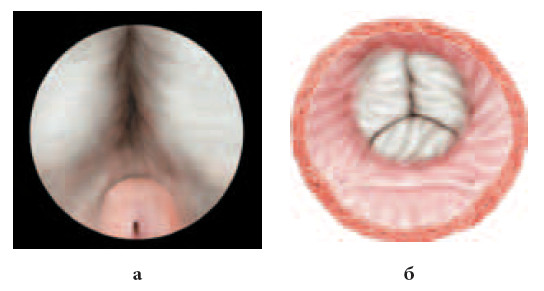
Рис. 1. Предварительный этап. Определение ориентиров зоны вмешательства: а – боковые доли простаты и семенной бугорок; б – вид боковых долей гиперплазии и устья мочеточников «со стороны мочевого пузыря»
Далее производится рассечение ткани гиперплазии простаты до хирургической капсулы по направлению от шейки мочевого пузыря до семенного бугорка справа и слева от средней доли. Сначала рассекают ткань на 5 часах условного циферблата. При этом формируется своего рода борозда, и важно, чтобы она имела четкие очертания, в особенности при больших размерах аденомы. Аналогичная борозда формируется на 7 часах условного циферблата (интраоперационная фотография и схемы представлены на рисунке 2).
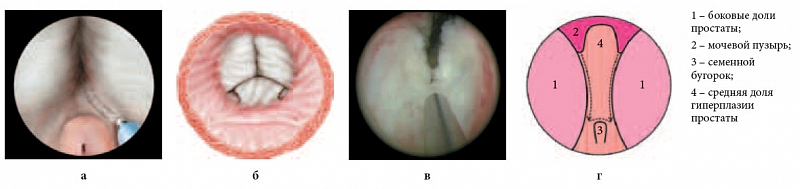
Рис. 2. Первый этап энуклеации. Формирование борозд справа и слева от средней доли гиперплазии простаты: а, б – объемная схема; в – интраоперационная фотография; г – графическая схема
Коагуляция кровоточащих сосудов обеспечивается путем отведения кончика волокна на 2–3 мм от сосуда. При полном отсутствии средней доли гиперплазии выполняется рассечение ткани на 6 часах условного циферблата. В дальнейшем производится энуклеация средней доли путем «соединения» сформированных борозд при помощи лазерного волокна и направленных движений от семенного бугорка к мочевому пузырю. При этом кончиком резектоскопа приподнимается энуклеированная ткань средней доли и постепенно смещается в мочевой пузырь (рис. 3).
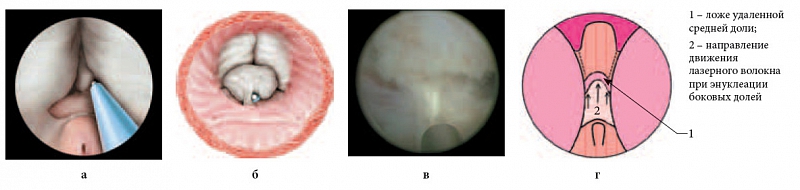
Рис. 3. Второй этап энуклеации. Соединение борозд с последующим смещением энуклеированной ткани простаты в мочевой пузырь: а, б – объемная схема; в – интраоперационная фотография; г – графическая схема
Вслед за этим приступают к последовательной энуклеации боковых долей, продолжая движение инструментом по направлению от средней линии латерально по ходу хирургической капсулы (рис. 4). По методике, предложенной P.J. Gilling, при вылущивании боковых долей волокно движется снизу от 5 и 7 часов условного циферблата до 2–3 и 9–10 часов соответственно, а затем с 12 часов латерально, и на 2 и 10 часах борозды соединяются.
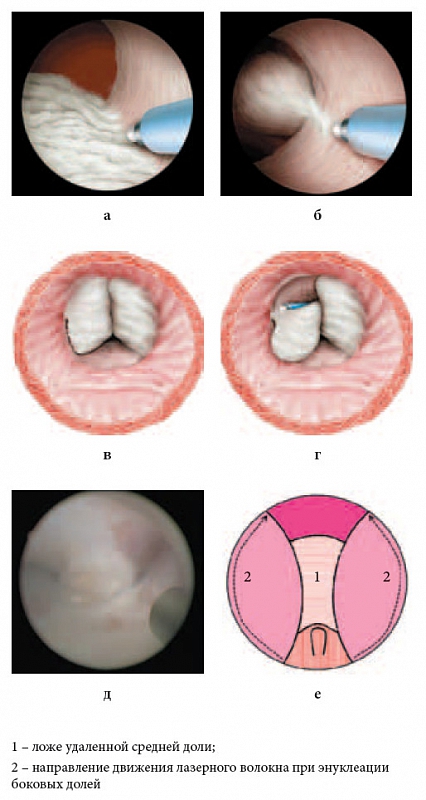
Рис. 4. Третий этап энуклеации. Энуклеация боковой доли: а, б, в, г – объемная схема; д – интраоперационная фотография; е – графическая схема
После завершения энуклеации долей гиперплазии простаты осуществляют тщательный окончательный гемостаз путем коагуляции кровоточащих сосудов, что достигается отведением кончика лазерного волокна на 2–3 мм от сосуда. Возможно осуществление дополнительного гемостаза в области шейки мочевого пузыря при помощи петли резектоскопа. Энуклеированные ткани удаляются из полости мочевого пузыря при помощи морцеллятора (рис. 5).
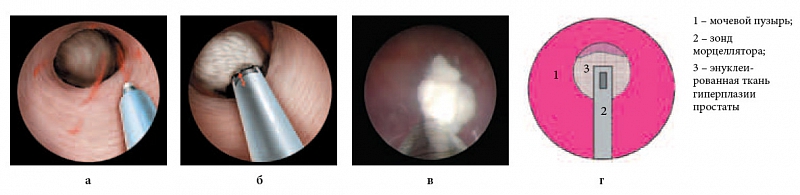
Рис. 5. Четвертый этап энуклеации. Морцелляция гиперплазированной ткани: а, б – объемная схема; в – интраоперационная фотография; г – графическая схема
Необходимо отметить, что морцелляция тканей производится после достижения полного гемостаза, что обеспечивает хорошую видимость, и исключительно при наполненном мочевом пузыре. Это предотвращает попадание в лезвие инструмента слизистой мочевого пузыря и повреждение последнего. При соблюдении необходимых условий морцелляция является абсолютно безопасной манипуляцией и позволяет удалять около 10 г ткани в минуту. Отдельные мелкие и плотные фрагменты аденоматозной ткани, которые трудно захватить лезвию морцеллятора, можно удалить при помощи специальной петли резектоскопа (рис. 6). После удаления инструмента мочевой пузырь дренируется трехходовым уретральным катетером Foley, по которому при необходимости осуществляется ирригация мочевого пузыря.
Результаты лечения больных гиперплазией предстательной железы при использовании лазерной (гольмиевой) энуклеации гиперплазии простаты
Последние данные клинических исследований выполнения гольмиевой лазерной энуклеации простаты позволяют предположить, что данная методика может стать альтернативой трансуретральной электрорезекции простаты – «золотому стандарту» лечения больных гиперплазией простаты. Значительное число зарубежных исследований посвящены изучению гольмиевой энуклеации, и с каждым годом их число возрастает по мере популярности, которую приобретает этот метод. Рассмотрим некоторые наиболее значимые работы и приведем результаты собственного опыта выполнения гольмиевой лазерной энуклеации.
В 2002 г. R.M. Kuntz и K. Lehrich [23] опубликовали результаты рандомизированного проспективного исследования, в ходе которого производился сравнительный анализ эффективности и безопасности применения гольмиевой энуклеации простаты и чреспузырной аденомэктомии при лечении пациентов с объемом простаты более 100 см³. В ходе исследования под наблюдением находились 120 пациентов с инфравезикальной обструкцией, обусловленной гиперплазией простаты больших размеров. Все пациенты были обследованы до проведения операции, а также через 1, 3 и 6 месяцев после операции. Объем простаты у всех пациентов превышал 100 см³. Одной группе пациентов (n = 60) была проведена гольмиевая лазерная энуклеация простаты, другой (n = 60) – открытая аденомэктомия. В группе пациентов, которым была выполнена гольмиевая энуклеация, 50 пациентам удаление частично энуклеированной ткани производилось при помощи трансуретральной электрорезекции (техника «гриба») [30], а 10 произведена механическая морцелляция ткани, при этом скорость морцелляции составила в среднем 3,9 г в минуту (от 1,5 до 7,5 г в минуту).
Объем простаты до операции в первой группе (HoLEP) составил 114,6 ± 21,6 см³, во второй (открытая аденомэктомия) – 113,0 ± 19,2 см³, при этом объем удаленной ткани составил 83,9 ± 21,9 и 96,4 ± 36,4 г соответственно. Операция HoLEP длилась дольше открытой аденомэктомии (135,9 и 90,6 минут соответственно), однако длительность катетеризации в случае лазерной энуклеации была значительно меньше, чем при проведении открытой аденомэктомии (в среднем 30,8 и 194,4 часа соответственно). Кровопотеря у пациентов в первой группе оказалась меньше. Снижение уровня гемоглобина составило 1,9 и 2,8 г/дл соответственно.
Через шесть месяцев после операции было выявлено значительное улучшение показателей максимальной скорости мочеиспускания в обеих группах. Так, в группе HoLEP Qmax составила 29,9 ± 8,8 мл/с, а в группе открытой аденомэктомии – 27,0 ± 0,5 мл/с. Индекс AUA SS снизился в обеих группах – 2,4 ± 1,9 и 2,8 ± 3,9 соответственно.
Известно, что у пациентов с гиперплазией простаты, принимающих антикоагулянтную терапию в постоянном режиме, выполнение трансуретральной электрорезекции простаты или открытой аденомэктомии сопряжено с высоким риском интра- и послеоперационных кровотечений. Использование в подобных случаях новых, лазерных оперативных методик может позволить избежать серьезных осложнений.
В 2005 г. E. Elzayat и соавт. [31] опубликовали результаты исследования выполнения гольмиевой лазерной энуклеации простаты пациентам с гиперплазией простаты, получающим антикоагулянтную терапию, а также пациентам с нарушениями гемостаза. В исследование было включено 83 пациента с доброкачественной гиперплазией простаты, принимавших регулярно пероральные антикоагулянтные препараты. Из общего числа пациентов 14 не прекращали прием антикоагулянтов, 34 пациентам эта терапия была заменена на низкомолекулярный гепарин, а 33 пациента прекратили прием антикоагулянтных препаратов перед операцией, в том числе 8 человек, которым проводилась антитромботическая терапия.
Некоторым пациентам (5,3%) потребовалось применение промывной системы в связи с кратковременным послеоперационным кровотечением. Одному пациенту, который не прекращал приема антитромботических препаратов, во время операции из-за кровотечения потребовалось переливание тромбоцитарной массы, и морцелляция была отложена из-за плохой видимости. Семи пациентам потребовалось переливание крови в ранние послеоперационные сроки (2–5 дней), объем переливаемой крови составил в среднем 3,7 доз. Трем пациентам с продолжающимся кровотечением была проведена цистоскопия с остановкой кровотечения. В среднем уровень гемоглобина до и после операции составил 13,5 и 12,2 г/дл соответственно. Авторы пришли к выводу, что гольмиевая энуклеация простаты является хорошей альтернативой трансуретральной вапоризации у данной категории больных.
В 2007 г. были опубликованы результаты трехлетнего наблюдения за пациентами, которым была проведена лазерная энуклеация с эндоморцелляцией удаленной ткани [32]. В проспективном исследовании, в котором оценивались безопасность, эффективность, а также продолжительность эффекта процедуры, участвовали 330 пациентов с инфравезикальной обструкцией, обусловленной гиперплазией простаты.
Средний объем простаты – 62 ± 34 см³. Длительность лазерной энуклеации составила 45,4 ± 22,9 минут, морцелляции – 17,3 ± 14 минут, а объем удаленной ткани – в среднем 40 ± 27,5 грамма. Длительность катетеризации после проведения операции равнялась 23 ± 14,7 часа, а общая длительность госпитализации – 48 ± 26 часов. Необходимо отметить, что не было отмечено значительного снижения гемоглобина и содержания натрия в крови (р = 013). При этом в течение 3 лет после проведения лазерной энуклеации (р < 0,05) значительно улучшились показатели максимальной скорости мочеиспускания (Qmax = 25,1 ± 10,7 мл/с), Международной шкалы оценки простатических симптомов (International Prostatic Symptom Score, IPSS) (0,7 ± 1,3), а также индекса качества жизни (Quality of life, QoL) (0,2 ± 0,5). 28% пациентов отметили сохранение ирритативных симптомов, которые, однако, в течение 3 месяцев регрессировали самостоятельно. В 7,3% случаев было зафиксировано кратковременное стрессовое недержание мочи. У 9 пациентов (2,7%) наблюдалась персистирующая инфравезикальная обструкция, требующая повторного хирургического вмешательства.
В клинике урологии Первого МГМУ им. И.М. Сеченова гольмиевая энуклеация гиперплазии простаты выполняется с 2009 г. Исходно нами использовалась лазерная установка (60 Вт) с многоразовым лазерным волокном 550 мкм фирмы Lumenis, в настоящее время операции выполняются на аналогичной установке мощностью 100 Вт. Лазерная (гольмиевая) энуклеация гиперплазии предстательной железы выполнена 63 пациентам в возрасте 51–79 лет (в среднем 62,1 ± 3,6 года), страдающим симптоматической гиперплазией предстательной железы. Объем простаты в среднем составил 62,8 ± 19,3 см³ (37–110 см³), IPSS – 21,2 ± 3,8 балла, индекс качества жизни (QoL) – 4,1 ± 0,8, максимальная скорость мочеиспускания – 8,2 ± 2,3 мл/с, объем остаточной мочи – 41,3 ± 45,1 мл.
Оперативное вмешательство при использовании установки мощностью 60 Вт в среднем длилось 115,6 ± 23,7 минуты, тогда как при использовании установки мощностью 100 Вт – 78,3 ± 21,6 минуты. Контрольное обследование проводилось через 1, 3 и 6 месяцев после операции. Объем предстательной железы после лазерной энуклеации к 6-му месяцу в среднем снизился с предоперационных значений в 62,8 ± 19,3 см³ до 18,2 ± 8,3 см³ (в относительных цифрах изменение составило 71%). Улучшение качества мочеиспускания после проведенного оперативного лечения нашло свое отражение в значительном изменении показателей урофлоуметрии и количества остаточной мочи. Удовлетворительная положительная динамика отмечена уже в течение первого месяца послеоперационного периода с наибольшим приростом Qmax к концу наблюдения через 6 месяцев. В среднем изменение Qmax к 6-му месяцу составило 18,5 мл/с (p < 0,05). Объем остаточной мочи у больных основной группы значительно снизился и к 6-му месяцу после операции составлял 15,4 ± 6,3 мл (p < 0,05). Через 6 месяцев индекс IPSS и QoL составили 5,6 и 1,9 балла соответственно (p < 0,05). Частота осложнений гольмиевой энуклеации в целом была низкая. В 2 случаях (3,2%) было отмечено кровотечение, потребовавшее выполнения повторной уретроцистоскопии и коагуляции кровоточащих сосудов, в одном случае спустя месяц после операции. В 2 случаях (3,2%) также было отмечено кратковременное недержание мочи после операции. Одному больному выполнена меатотомия в связи с развившимся меатостенозом.
Таким образом, полученные нами данные свидетельствуют о сходной клинической эффективности изучаемых методов, при этом лазерная гольмиевая энуклеация гиперплазии простаты не имеет ограничений по объему предстательной железы, обеспечивает меньший риск возникновения кровотечения в интра- и послеоперационном периоде, исключает развитие синдрома «водной интоксикации», позволяет сократить вероятность возникновения инфекционно-воспалительных осложнений за счет сокращения сроков нахождения уретрального катетера и периода пребывания больного в стационаре. В этой связи гольмиевая энуклеация гиперплазии простаты может стать альтернативой стандартной монополярной трансуретральной резекции при выборе метода оперативного лечения больных ДГПЖ.
Показания и противопоказания к применению лазерной гольмиевой энуклеации гиперплазии предстательной железы в клинической практике
В соответствии с рекомендациями Международного согласительного комитета по проблемам доброкачественной гиперплазии предстательной железы (Paris, 2006) показания к гольмиевой энуклеации практически не отличаются от таковых при стандартной трансуретральной монополярной резекции. Это подтверждено нашим собственным клиническим опытом. Однако наличие у больных ряда сопутствующих заболеваний, связанных с нарушением свертывающей системы крови или систематическим приемом антикоагулянтов и повышенным риском геморрагических осложнений, ограничивает возможность применения стандартной трансуретральной резекции гиперплазии простаты. В таких случаях выполнение лазерной гольмиевой энуклеации гиперплазии простаты является альтернативой трансуретральной электрорезекции, а у пациентов с аденомой больших размеров – предпочтительным методом оперативного лечения.
Электробезопасность лазерной гольмиевой энуклеации позволяет выполнять оперативное вмешательство пациентам с наличием искусственного водителя ритма, кардиостимулятора, металлического фиксирующего устройства костного скелета без риска развития интраоперационных осложнений.
Нарушение вегетативной иннервации, связанной с реакцией пещеристых нервных волокон на электрический ток при использовании монополярных инструментов, может привести к возникновению эректильной дисфункции, поэтому пациентам молодого возраста, заинтересованным в сохранении эректильной функции, предпочтительно выполнение лазерной энуклеации.
Опираясь на наш собственный опыт, мы считаем возможным применение лазерной энуклеации у больных с объемом простаты любого размера при наличии технической возможности использования морцеллятора.
Абсолютным противопоказанием к выполнению трансуретральной гольмиевой энуклеации является крайне тяжелое состояние больного, находящегося в состоянии декомпенсации жизненно важных органов, и наличие острых воспалительных заболеваний, что не отличается от таковых для любого другого планового оперативного вмешательства. Оперативное вмешательство не может быть выполнено при технической невозможности проведения резектоскопа по уретре в мочевой пузырь (анкилоз тазобедренных суставов, выраженная и протяженная стриктура уретры).
Относительным противопоказанием является наличие у больного микроцистиса, что может помешать безопасному проведению морцелляции гиперплазированной ткани.
Трудности освоения лазерной гольмиевой энуклеации гиперплазии простаты
Одним из самих обсуждаемых аспектов гольмиевой энуклеации гиперплазии предстательной железы как в литературе, так и на различных урологических научно-практических мероприятиях является сложность овладения методикой. Согласно данным литературы, обучающемуся необходимо выполнить порядка 20 операций, для того чтобы его показатели (продолжительность энуклеации, продолжительность морцелляции, объем удаленной ткани) были сопоставимы с таковыми опытного хирурга. Приведем важные моменты, знание которых поможет специалисту быстрее овладеть данной методикой.
Овладеть данной методикой человеку, не имеющему опыта эндоскопических операций, сложнее, чем методикой трансуретральной электрорезекции. В большей степени это связано с тем, что весьма затруднительно сориентироваться и попасть в нужный «слой». Между тем это является самым важным этапом, обеспечивающим и безопасность, и эффективность данной процедуры. Хирургу, имеющему опыт выполнения трансуретральных резекций, проще идентифицировать хирургическую капсулу гиперплазии от ткани аденомы и продолжить движения в нужном слое – по ходу хирургической капсулы.
Еще один важный момент – выбор правильной геометрии движений лазерного волокна, что во многом облегчает и ускоряет процесс энуклеации долей гиперплазии. Необходимо правильно представлять себе форму гиперплазированной ткани и остающуюся после ее удаления полость. При нахождении в нужном слое и совершении правильных движений процесс отделения гиперплазированной ткани, по сути вылущивания ее, обычно происходит достаточно легко под действием механической силы, передаваемой инструменту, а лазерная энергия облегчает этот процесс и обеспечивает гемостаз. В случае нахождения вне нужного пространства между аденомой и хирургической капсулой цвет ткани меняется. При резании ткань аденомы желто-коричневатого цвета, кроме того, она немного более однородна и упруга. Хирургическая капсула белесая, с несколькими слоями концентрических волокон, придающих ей некоторую исчерченность. Если хирург обнаруживает, что находится вне правильного слоя, следует предпринять попытку реориентации и поиска нужного слоя. В случае безуспешных попыток и окончательной «потери» в тканях целесообразно завершить операцию стандартной трансуретральной электрорезекцией. Для того чтобы снизить риск потери правильного направления энуклеации и «потери» слоя, что особенно актуально на начальных этапах освоения методики, нами предложена модификация выполнения энуклеации. Напомним, что методике, предложенной P.J. Gilling, при энуклеации боковых долей борозды формируются до 2 и 10 часов условного циферблата и вылущивание завершается при помощи борозды, идущей от 12 часов латерально в обе стороны. На этом этапе высок риск несовпадения борозд. В этой связи нам представляется целесообразным продолжение борозд, идущих от ложа удаленной средней доли, не до 2 и 10 часов, а до 12 часов, с последующим завершением вылущивания путем выполнения инцизии на 12 часах. Это позволяет избежать «потери» нужного слоя и уменьшить время энуклеации.
Не менее важным является завершающий этап – морцелляция энуклеированных долей. Главным условием безопасного выполнения морцелляции является достаточное наполнение мочевого пузыря при хорошей видимости. Приступать к морцелляции можно только, если хирург уверен, что риск повреждения стенки мочевого пузыря отсутствует. Для облегчения захвата в «окошко» ножа морцеллятора гиперплазированной ткани целесообразно перед завершением энуклеации сделать борозды на аденоматозной ткани при помощи лазерного волокна. Попадая в эти борозды, нож морцеллятора легко захватывает ткань для последующего измельчения. Мелкие фрагменты ткани могут быть удалены из полости мочевого пузыря при помощи шприца Рене Александера.
Кроме того, начинающему хирургу мы рекомендуем обращаться к видеозаписям подобных операций, поскольку это позволяет лучше рассмотреть и изучить все детали. Считаем, что лучше начинать выполнение подобных операций при железах малого и среднего объема.
В завершение можно сказать, что для успешного и скорейшего овладения методикой лазерной энуклеации гиперплазии простаты необходимо полное инструментальное обеспечение, а также предпочтительно наличие лазерной установки мощностью 100 Вт.
Источник: www.umedp.ru Гольмиевая энуклеация простаты в лечении больных доброкачественной гиперплазией предстательной железы Дымов А.М. Локшин К.Л. Первый Московский государственный медицинский университет им. И.М. Сеченова, НИИ уронефрологии и репродуктивного здоровья человека 2013г.