 Радикальной простатэктомии (РПЭ), как и любому методу оперативного лечения, присущи недостатки, к которым в первую очередь относится развитие различных осложнений. Несмотря на усовершенствование оперативной техники, частота развития обструктивных осложнений после перенесенной ранее РПЭ остается весьма высокой и, по данным ряда авторов, колеблется в диапазоне 2,7–25,5%. Целью работы явилось определение частоты и сроков развития обструктивных осложнений уретроцистоанастомоза (УЦА) после РПЭ, определение оптимальной тактики лечения таких пациентов.
Радикальной простатэктомии (РПЭ), как и любому методу оперативного лечения, присущи недостатки, к которым в первую очередь относится развитие различных осложнений. Несмотря на усовершенствование оперативной техники, частота развития обструктивных осложнений после перенесенной ранее РПЭ остается весьма высокой и, по данным ряда авторов, колеблется в диапазоне 2,7–25,5%. Целью работы явилось определение частоты и сроков развития обструктивных осложнений уретроцистоанастомоза (УЦА) после РПЭ, определение оптимальной тактики лечения таких пациентов.
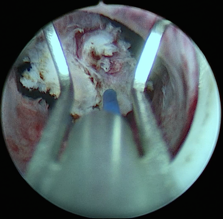
Материал и методы. В основу настоящего исследования положен ретро- и проспективный анализ клинических наблюдений группы из 99 пациентов после открытой (51 пациент), лапараскопической/экстраперитонеоскопической (42) и роботизированной (6) простатэктомии, которые имели обструктивные осложнения и наблюдались нами в ГКУБ No 47 и ГКБ No 57 г. Москвы с 2000 г. Возраст пациентов варьировал в диапазоне 56–80 лет, средний возраст составил 68,6 года. Стадия Т1 была диагностирована у 11пациентов,Т2–у72,Т3–у 16 больных. Сумма по Глисону 4–6 была выявлена у 65 па- циентов, 7–8 – у 34. Размеры простаты менее 40 см3 были у 59 больных, 40–60 см3 – у 28, более 60 см3 – у 12. Сроки возникновения стриктур анастомоза от момента операции составили: менее 3 месяцев – у 20 больных, 3–12 месяцев – у 67, более 12 месяцев – у 12 пациентов. Всем пациентам были выполнены различные эндоскопические вмешательства по поводу обструкции УЦА: инцизия холодным ножом, монополярная и биполярная электроинцизия, а также различные методы лазерной хирургии (инцизия, вапоризация, аблация, резекция анастомоза), которые у ряда больных заканчивались имплантацией уретрального или простатического стента.
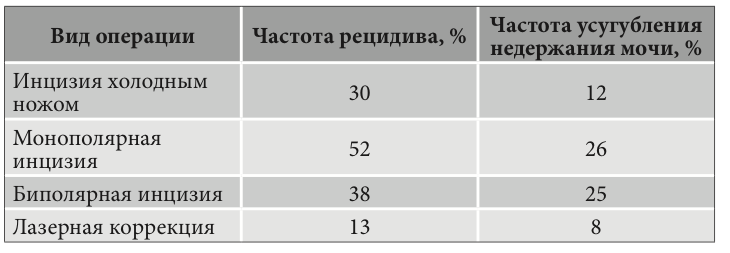
Результаты и их обсуждение. Частота развития стриктур УЦА в первую очередь зависела от опыта оперирующего хирурга. Симптоматика нарушения мочеиспускания у большинства больных манифестировала в первые 3–12 месяцев после РПЭ и практически не зависела от клинических проявлений заболевания. Основными факторами риска развития стриктур явились сроки дренирования мочевого пузыря уретральным катетером, техника наложения анастомоза, индекс массы тела, продолжительность оперативного вмешательства и применение нервосберегающей методики. Максимальное количество выполненных эндоскопических оперативных пособий у одного пациента по поводу рецидивной стриктуры УЦА составило 5 раз. При сравнении эффективности методов эндоскопического лечения обструкции УЦА помимо оценки частоты развития рецидива изучали частоту усугубления недержания мочи, за которую принимали увеличение количества используемых урологических прокладок более чем на две в сутки. Полученные результаты лечения приведены в таблице. Полученные данные наглядно демонстри- руют статистически значимую эффективность применения лазерных методов коррекции зоны уретроцистоанастомоза в сравнении с другими эндоскопическими методиками (p ≤ 0,05).
Выводы. Лечение пациентов с обструкцией УЦА после РПЭ является сложным и нередко многоэтапным процессом. После ряда безуспешных попыток зачастую сложно решить, каким должен быть следующий шаг. Несмотря на малоинвазивность эндоскопических методик, нет единого подхода к лечению таких пациентов, однако их применение, особенно с использованием гольмиевого лазера, можно считать достаточно эффективным для коррекции обструктивных осложнений радикальной простатэктомии.
Авторы: Методы эндоскопического лечения стриктур уретроцистоанастомоза после радикальной простатэктомии Джалилов Д.О., Мартов А.Г., Абдуллаев Д.А. ИПК ФМБА, кафедра урологии, Москва, Россия Российская медицинская академия последипломного образования, кафедра эндоскопической урологии, Москва, Россия, Городская клиническая больница No 57, Москва, Россия 2014г.