Применение нейросетевого моделирования при мониторинге пациентов, перенесших радикальную простатэктомию
Введение
Рак предстательной железы (РПЖ) — наиболее распространенная злокачественная опухоль у мужчин. С возрастом заболеваемость РПЖ увеличивается гораздо быстрее, чем заболеваемость другими злокачественными опухолями. РПЖ является причиной смерти 3 % мужчин старше 50 лет. Риск случайного обнаружения рака у мужчин в возрасте 50 лет составляет около 40 % [1]. Среди причин смерти мужчин от злокачественных новообразований РПЖ в настоящее время занимает 2-е место после рака легких, а риск развития РПЖ имеется у каждого мужчины независимо от того, есть ли симптомы заболевания предстательной железы (ПЖ) [2]. Онкоурология сегодня обладает широкими возможностями для ранней диагностики РПЖ, что позволяет выявлять злокачественный процесс в железе на клинически локализованных стадиях (Т1?Т2) тогда, когда можно добиться полного излечения заболевания после выполнения радикальной простатэктомии (РПЭ). Но всегда у оперирующего хирурга остаются сомнения в том, насколько достоверно дооперационное стадирование, насколько целесообразно проведение такой объемной операции. Одними из первых попыток прогнозирования данных патоморфологического заключения были таблицы
Партина и номограммы Катана [3?5] — прогностические модели, разработанные на основе данных больших когорт пациентов, однако их достоверность не превышает 50?80 %, поэтому разработки более точных прогностических моделей продолжались. Так, в Memorial SloanKettering Cancer Center создана номограмма, учитывающая возраст, уровень простатспецифического антигена (ПСА), первичный и вторичный показатели Глисона, количество положительных и отрицательных биоптатов, клиническую стадию, что позволяет более точно про-
гнозировать патоморфологическую стадию. Параллельно с ней создана номограмма Европейского общества урологов, которая учитывает лишь возраст пациентов, уровень ПСА, стадию заболевания. Нетрудно предположить, что клиницисту приходится учитывать большее чисто параметров, чтобы составить для себя представление об истинной картине заболевания. Возникает потребность в такой математической модели, которая способна содержать в себе возможности человеческого мозга, а именно уникальные свойства нейронов по обработке поступающей информации [6]. Это стало возможным при применении в разработке прогностических моделей элементов нейронных сетей. Цель исследования — анализ результатов применения интеллектуальной системы прогнозирования и мониторинга РПЖ с элементами нейронных сетей у пациентов, перенесших РПЭ.
Материалы и методы
Совместно с кафедрой высшей математики № 2 МИЭТ разработана интеллектуальная система мониторинга РПЖ с элементами нейронных сетей на базе программы Matlab. Система характеризуется удобной реализацией графического интерфейса, встроенными функциями для построения нейронной сети с высокими показателями обучаемости, хорошей достоверностью предполагаемых результатов и возможностью совмещать несколько сред разработок (информационный и интеллектуальный компонент). Также удалось получить дружественный GUI — интерфейс, позволяющий разобраться практикующему врачу в программе без особых сложностей. Информационный компонент представлен реляционной базой данных пациентов и их учетной и диагностической информацией (результаты анализов, тестов, симптомы и др.). Интеллектуальный компонент обеспечивает интегрированную процедуру поддержки процесса диагностbки заболеваний урологического профиля на основе нейросетевого моделирования. С учетом особенностей клинико-лабораторных показателей, данных ультра-
звукового исследования и магнитно-резонансной томографии пациентов
предложен алгоритм диагностики осложнений течения послеоперационного периода. На примере каждого клинического случая создана диагностическая модель, совокупность которых участвует в обучении системы.
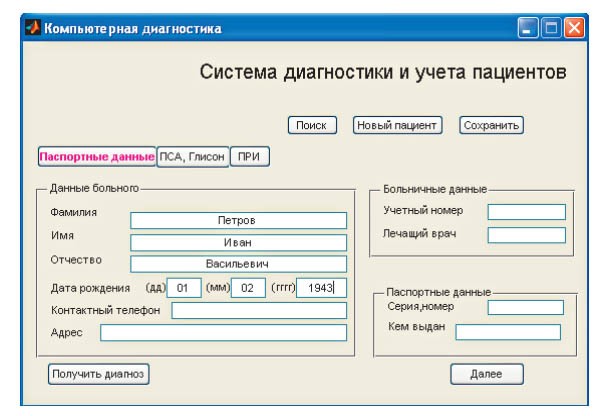
Создан удобный для пользователя любого уровня интерфейс, в котором отражены основные показатели
ввода данных (рис. 1). Две последующие формы помогают стадировать опухолевый процесс (рис. 2). После введения данных и обработки полученной информации система в процентном показателе выдает вероятный прогноз (рис. 3). В настоящее время в исследовании участвуют 174 пациента. Позадилонная РПЭ выполнена 169 больным. В 12 случаях с клинически местно-распространенной формой (Т3) РПЖ выполнена расширенная тазовая лимфодиссекция; 5 пациентам, ввиду сопутствующих заболеваний имеющим крайне высокую степень анестезиологического риска, проводится гормональная (ингибиторы лютеинизирующего гормона рилизинг-гормона) и дистанционная лучевая
терапия; 11 пациентам с сохраненной эректильной функцией, низким уровнем ПСА, небольшим процентом поражения ПЖ по данным биопсии, суммой баллов по шкале Глисона (индекс Глисона) < 7 операция выполнялась с применением нервосберегающей техники.
Средний возраст пациентов 68 лет, клинически локализованные формы рака (Т1?Т2) отмечены у 157 (92,8 %), местно-распространенный процесс (Т3) — у 12 (7,1%) больных. В послеоперационном гистологическом заключении учитывались следующие показатели: индекс Глисона, объем поражения ПЖ, наличие прорастания капсулы железы, периневральной и васкулярной инвазии, вовлечение семенных пузырьков, поражение регионарных лимфатических узлов, наличие положительного хирургического края. Патоморфологами в 2 случаях установлен диагноз pT0N0M0, локализованные формы диагностированы в 122 (72,2 %), местно-распространенные — в 45 (26,7 %) случаях
Результаты и обсуждение
На разных сроках наблюдения у 120 пациентов уровень ПСА составил 0,0 нг/мл, что предполагает дальнейшее динамическое наблюдение. У 14 пациентов возник биохимический рецидив, потребовавший биопсии ложа ПЖ и дальнейшей лучевой и гормональной терапии (табл. 2).
У некоторых больных остаются элементы недержания мочи в течение года. У 1 пациента возникла необходимость в имплантации искусственного сфинктера. У 9 больных развились стриктуры уретровезикального анастомоза, потребовавшие выполнения уретротомии; в 2 случаях выполнялись повторные внутренние оптические уретротомии; 3 пациента периодически проходят процедуру бужирования. У 2
больных со стриктурой уретровезикального анастомоза сформировались камни в мочевом пузыре, потребовавшие проведения цистолитотрипсии.У 89 % больных, перенесших операцию без нервосбережения, наблюдается эректильная дисфункция, однако применение ингибиторов фосфодиэстеразы 5-го типа позволило 5 % больных в течение года добиться возникновения эрекции, достаточной для проведения полового акта. При применении операции с нервосберегающей техникой у 3 из 11 таких больных сохраняется эректильная функция. Для обучения системы необходимо большое число примеров (150?200 больных), после чего на примере еще 100?150 пациентов система будет опробована как прогностическая модель.
Выводы
Любая прогностическая модель является результатом ретроспективного анализа. Она отражает подходы к диагностике и лечению именно той группы больных, которые включены в исследование. Номограмма позволяет прогнозировать на предоперационном этапе степень распространенности РПЖ, вовлечение семенных пузырьков, поражение лимфатических узлов, 5-летнюю выживаемость у пациентов с РПЖ, осуществлять послеоперационный мониторинг за больными после РПЭ, повысить качество оказываемой урологами и онкологами помощи
как в стационарах, так и на поликлиническом этапе. Работа над программой продолжается, пополняется база данных, однако уже сейчас ясно, что номограмма позволит значительно облегчить процесс клинического стадирования РПЖ и принятие решения по выработке тактики наблюдения и лечения больных, перенесших РПЭ.
Источник: Онкоурология 4, 2011г, Авторы: И.В. Лукьянов, Н.А. Демченко Кафедра урологии и хирургической андрологии ГОУ ДПО РМАПО, МоскваКонтакты: Игорь Вячеславович Лукьянов i.v.lukianov@mail.ru,
Литература:
1. Трапезников Н.Н., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ, 2001.
2. Parker S.L., Tong T., Bolden S. et al. Cancer statistics. CA Cancer J Clin 1997; 47:5?27.
3. Ohori M., Kattan M.W., Koh H. et al.Predicting the presence and side of extracapslarextension: a nomogram for stagingprostate cancer. J Urol 2004; 171:1844?9.
4. Partin A.W., Carter H.B. The use ofprostate-specific antigen and free/total prostate-specific antigen in the diagnosis oflocalized prostate cancer. Urol Clin NorthAm 1996;23(4):531?40.
5. Partin A.W., Kattan M.W., Subong E.N. et al. Combination of prostate-specificantigen, clinical stage, and Gleason scoreto predict pathological stage of localizedprostate cancer. A multi-institutionalupdate. JAMA 1997;277(18):1445?51.
6. Миркес Е.М. Нейроинформатика. М.: ИПЦ КГТУ, 2002.