История трансуретральных операций насчитывает около четырех столетий. Впервые трансуретральная операция по восстановлению проходимости в уретре вследствие стриктуры уретры была выполнена знаменитым французским хирургом Ambruise Pare в шестнадцатом столетии с использованием кюретки и заостренного полого бужа. В дальнейшем этот метод был улучшен другими французскими хирургами — Мерсье, Сивиалем и Д’Этуалем в 1830 году ( Roehrborn C.G., 1996). В соответствии с «Историей трансуретральной простатэктомии», Р.М. Несбита, современная трансуретральная резекция появилась в результате многочисленных технических достижений, первым из которых явилось создание лампы накаливания Эдисона в 1879 году (Mebust W. K. et al., 1989). Вторым было открытие Герцем в 1888 году высокочастотного переменного тока и третьим стало изобретение Хамптоном – младшим в 1909 году окончатого зонда, обеспечивающего доступ и позволяющего рассечение тканей через оконца (Nesbit R., 1975). Впервые электрический ток, определенной частоты, для нагревания тканей без повреждения мышц и возбуждения нервных окончаний применил в 1891 году французский ученый д’Арсонваль ( Левковский Н.C. 2002 ; Цариченко Д. Г., 2001 ). После применения Штерном в 1926 году вольфрамовой проволочной петли для резекции тканей, Маккарти объединил все вышеупомянутые достижения и использовал прямой резектоскоп с линзами, изготовленный Рейнхольдом Вапплером, и проволочную петлю для резекции тканей простаты. Последовавшее за этим изобретение Вапплера комплексного генератора привело к возможности использования одного и того же электрохирургического прибора для получения как режущего, так и коагулирующего тока (Chander J. et al , 2003). Дальнейшие улучшения связаны с развитием волоконно-оптических осветительных систем и изобретением в 1970 году широко-фокусных линз Хопкинса, а также с применением резектоскопа с постоянным током жидкости, описанного Иглесиасом в 1975 году (Цариченко Д.Г., 2001). Использование современного видеооборудования позволяет хирургу работать, наблюдая происходящие события не через линзу, а на мониторе, что является дополнительным усовершенствованием методики трансуретральных операций. Революционные изменения в эндоурологии, связанные с появлением в 70 гг. 20 века фиброоптики и мощных источников света, сменились 20- летним перерывом, и только середина 1990-х гг. отмечена бурным развитием новых технологий в электрохирургии. В последние десятилетия появились технические усовершенствования инструментария и разработки принципиально новых идей выполнения трансуретральных вмешательств направленные на предупреждение ряда интраоперационных и послеоперационных осложнений.
История трансуретральных операций насчитывает около четырех столетий. Впервые трансуретральная операция по восстановлению проходимости в уретре вследствие стриктуры уретры была выполнена знаменитым французским хирургом Ambruise Pare в шестнадцатом столетии с использованием кюретки и заостренного полого бужа. В дальнейшем этот метод был улучшен другими французскими хирургами — Мерсье, Сивиалем и Д’Этуалем в 1830 году ( Roehrborn C.G., 1996). В соответствии с «Историей трансуретральной простатэктомии», Р.М. Несбита, современная трансуретральная резекция появилась в результате многочисленных технических достижений, первым из которых явилось создание лампы накаливания Эдисона в 1879 году (Mebust W. K. et al., 1989). Вторым было открытие Герцем в 1888 году высокочастотного переменного тока и третьим стало изобретение Хамптоном – младшим в 1909 году окончатого зонда, обеспечивающего доступ и позволяющего рассечение тканей через оконца (Nesbit R., 1975). Впервые электрический ток, определенной частоты, для нагревания тканей без повреждения мышц и возбуждения нервных окончаний применил в 1891 году французский ученый д’Арсонваль ( Левковский Н.C. 2002 ; Цариченко Д. Г., 2001 ). После применения Штерном в 1926 году вольфрамовой проволочной петли для резекции тканей, Маккарти объединил все вышеупомянутые достижения и использовал прямой резектоскоп с линзами, изготовленный Рейнхольдом Вапплером, и проволочную петлю для резекции тканей простаты. Последовавшее за этим изобретение Вапплера комплексного генератора привело к возможности использования одного и того же электрохирургического прибора для получения как режущего, так и коагулирующего тока (Chander J. et al , 2003). Дальнейшие улучшения связаны с развитием волоконно-оптических осветительных систем и изобретением в 1970 году широко-фокусных линз Хопкинса, а также с применением резектоскопа с постоянным током жидкости, описанного Иглесиасом в 1975 году (Цариченко Д.Г., 2001). Использование современного видеооборудования позволяет хирургу работать, наблюдая происходящие события не через линзу, а на мониторе, что является дополнительным усовершенствованием методики трансуретральных операций. Революционные изменения в эндоурологии, связанные с появлением в 70 гг. 20 века фиброоптики и мощных источников света, сменились 20- летним перерывом, и только середина 1990-х гг. отмечена бурным развитием новых технологий в электрохирургии. В последние десятилетия появились технические усовершенствования инструментария и разработки принципиально новых идей выполнения трансуретральных вмешательств направленные на предупреждение ряда интраоперационных и послеоперационных осложнений.Трансуретральная электрохирургия в лечении гиперплазии предстательной железы и опухолей мочевого пузыря.
История трансуретральных операций насчитывает около четырех столетий. Впервые трансуретральная операция по восстановлению проходимости в уретре вследствие стриктуры уретры была выполнена знаменитым французским хирургом Ambruise Pare в шестнадцатом столетии с использованием кюретки и заостренного полого бужа. В дальнейшем этот метод был улучшен другими французскими хирургами — Мерсье, Сивиалем и Д’Этуалем в 1830 году ( Roehrborn C.G., 1996). В соответствии с «Историей трансуретральной простатэктомии», Р.М. Несбита, современная трансуретральная резекция появилась в результате многочисленных технических достижений, первым из которых явилось создание лампы накаливания Эдисона в 1879 году (Mebust W. K. et al., 1989). Вторым было открытие Герцем в 1888 году высокочастотного переменного тока и третьим стало изобретение Хамптоном – младшим в 1909 году окончатого зонда, обеспечивающего доступ и позволяющего рассечение тканей через оконца (Nesbit R., 1975). Впервые электрический ток, определенной частоты, для нагревания тканей без повреждения мышц и возбуждения нервных окончаний применил в 1891 году французский ученый д’Арсонваль ( Левковский Н.C. 2002 ; Цариченко Д. Г., 2001 ). После применения Штерном в 1926 году вольфрамовой проволочной петли для резекции тканей, Маккарти объединил все вышеупомянутые достижения и использовал прямой резектоскоп с линзами, изготовленный Рейнхольдом Вапплером, и проволочную петлю для резекции тканей простаты. Последовавшее за этим изобретение Вапплера комплексного генератора привело к возможности использования одного и того же электрохирургического прибора для получения как режущего, так и коагулирующего тока (Chander J. et al , 2003). Дальнейшие улучшения связаны с развитием волоконно-оптических осветительных систем и изобретением в 1970 году широко-фокусных линз Хопкинса, а также с применением резектоскопа с постоянным током жидкости, описанного Иглесиасом в 1975 году (Цариченко Д.Г., 2001). Использование современного видеооборудования позволяет хирургу работать, наблюдая происходящие события не через линзу, а на мониторе, что является дополнительным усовершенствованием методики трансуретральных операций. Революционные изменения в эндоурологии, связанные с появлением в 70 гг. 20 века фиброоптики и мощных источников света, сменились 20- летним перерывом, и только середина 1990-х гг. отмечена бурным развитием новых технологий в электрохирургии. В последние десятилетия появились технические усовершенствования инструментария и разработки принципиально новых идей выполнения трансуретральных вмешательств направленные на предупреждение ряда интраоперационных и послеоперационных осложнений.
Современные электрохирургические приборы для рассечения ткани и выполнения гемостаза используют переменный ток с частотой более 100 кГц, что обусловлено стимулирующим влиянием более низких частот на мышцы и нервные волокна. Верхний порог частоты ограничен приблизительно одним МГц, так как сверхвысокочастотные токи, обладая мощной индуктивностью, распространяются за пределы контролируемой электрической цепи и могут вызывать значительные реактивные явления.
Обычный электрический ток (60 Гц) преобразуется генератором в ток высокой частоты с необходимыми параметрами. Конечный эффект взаимодействия тока с тканями определяется как его характеристиками, так и свойствами самой ткани. По определению, переменный ток определенной мощности с формой волны в виде правильной непрерывной синусоиды является режущим. Прерывистая волна с постепенно снижающейся амплитудой вызывает коагуляцию. Основные эффекты, происходящие в ткани при воздействии тока, обусловлены превращением электрической энергии в термическую. Под действием переменного электрического тока, ткани претерпевают ряд термоспецифических изменений при переходе электрической энергии в термическую. Повышение температуры 43-45 ?С вызывает ретракцию ткани; при 50 ?С снижается активность ферментных систем; при 50-60 ?С происходит денатурация белков; достигая температуры 90-100 ?С, ткань интенсивно теряет жидкость ( высушивается); при 100 ?С и более вода закипает и переходит в пар. Для достижении карбонизации необходимо повышение температуры ткани до 150 ?С , а вапоризация происходит при 300 градусах и более. При достижении тканью очень высокой температуры ( более 500?С ) возможно краевое воспламенение.
При монополярной электрохирургии электрический ток проходит определенное расстояние через ткани пациента от активного элекрода с небольшой поверхностью (площадью поперечного сечения) к пассивному, поперечное сечение которого значительно больше. Роль активного электрода выполняет резекционная петля или коагулирующий (вапоризующий) электрод (рисунок №1), а пассивного — широкая пластина из металла, подкладываемая обычно под крестцовую область. В основе монополярной хирургии лежит резкое повышение сопротивления переменному импульсно-синусоидальному электрическому току высокой частоты в месте соприкосновения активного электрода с тканью. Данный процесс сопроваждается переходом электрической энергии в тепловую и приводит к резкому повышению температуры вне- и внутриклеточной жидкости более 100 ?С. При этом образуется зона интенсивного кипения разрушающая клетки – электрохирургический разрез ткани. Для предотвращения утечки тока в качестве ирригантов обычно используются слабо гипертонические растворы (3% раствор мочевины, 9% раствор маннитола, 8% раствор глюкозы). Вне зависимости от типа используемого электрода (валика, проволочной или выпаривающей петли) принцип монополярной электрохирургии остается неизменным. Меняется лишь 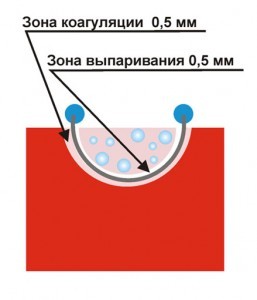 уровень мощности электрогенератора в соответствии с площадью поверхности активного электрода. Во время рассечения ткани проволочной петлей описанные выше физические эффекты происходят на очень ограниченном объеме ткани: зона кипения, где разрушается ткань, чуть больше сечения петли, при этом зона коагуляции составляет 0,1-0,5 мм (рисунок № 2). Силовые линии токов направлены в глубину ткани мочевого пузыря и стремятся к пассивному электроду.
уровень мощности электрогенератора в соответствии с площадью поверхности активного электрода. Во время рассечения ткани проволочной петлей описанные выше физические эффекты происходят на очень ограниченном объеме ткани: зона кипения, где разрушается ткань, чуть больше сечения петли, при этом зона коагуляции составляет 0,1-0,5 мм (рисунок № 2). Силовые линии токов направлены в глубину ткани мочевого пузыря и стремятся к пассивному электроду.
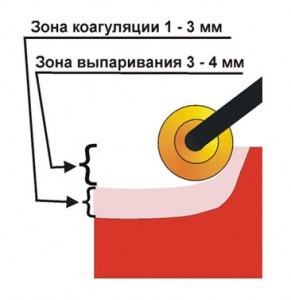
При применении выпаривающих электродов в режимеобразуется зона интенсивного кипения, разрушающая клетки на глубину 3-4 мм, а на 1-3 мм подлежащая ткань коагулируется (рисунок № 3 и №4). При этом силовые линии так же направлены в толщу стенки мочевого пузыря, однако число их увеличивается в связи с большей рабочей площадью активных электродов.
 Для остановки кровотечения используют коагулирующий режим, при котором подается чистый импульсный ток.
Для остановки кровотечения используют коагулирующий режим, при котором подается чистый импульсный ток.
По данным Американской 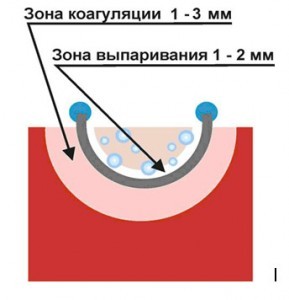 и Европейской урологических ассоциаций трансуретральная резекция является «золотым стандартом» эндоскопического лечения инфравезикальной обструкции, обусловленной доброкачественной гиперплазией простаты и поверхностных опухолей мочевого пузыря. У больных опухолью мочевого пузыря трансуретральная резекция является ведущим способом установления морфологического диагноза и стадирования процесса, а также методом радикального лечения поверхностного рака в комплексе с иммуно-, химиотерапией ( Лопаткин Н.А. и соавт. 1999, Матвеев Б.П. и соавт.,2001, McKiernan J.M et al, 1996, Mebust W.K., et al, 1989, Reynard J. et al, 1992). В многочисленных работах приводятся следующие преимущества ТУР перед открытыми операциями: отсутствие рассечения здоровых тканей при подходе к патологическому очагу, надежный контроль за гемостазом, более легкое течение послеоперационного периода и сокращение периода госпитализации, возможность применения операции у пациентов пожилого и старческого возраста с выраженными сопутствующими заболеваниями (Аляев Ю.Г. и соавт., 2005, Коган М.И и соавт., 1996, Мартов А.Г. и соавт., 1997, Wendt-Nordahl G. et al., 2004, Wescott J.W, 2004). Однако накопленный многочисленный опыт данных вмешательств показал, что имеются, как интраоперационные, так и послеоперационные осложнения, в том числе и отдаленные неудовлетворительные результаты оперативного лечения. К числу осложнений относятся: кровотечение, «ТУР – синдром», неконтролируемая перфорация мочевого пузыря, из-за стимуляции запирательного нерва, неполное удаление опухоли, плохая операционная видимость и потеря ориентации при массивном кровотечении, гнойно-воспалительные заболевания органов мочеполовой системы, длительно не проходящие ирритативные симптомы (Астафьев В.В., 1985, Тоскано М.Б. и соавт., 1990, Камалов А.А. и соавт, 1999, Лопаткин Н.А. и соавт., 1997, Мартов А.Г. и соавт, 1997, Симонов В.Я., 1987, Ситдыков Э. Н. и соавт., 1990, Цариченко Д. Г., 2000).
и Европейской урологических ассоциаций трансуретральная резекция является «золотым стандартом» эндоскопического лечения инфравезикальной обструкции, обусловленной доброкачественной гиперплазией простаты и поверхностных опухолей мочевого пузыря. У больных опухолью мочевого пузыря трансуретральная резекция является ведущим способом установления морфологического диагноза и стадирования процесса, а также методом радикального лечения поверхностного рака в комплексе с иммуно-, химиотерапией ( Лопаткин Н.А. и соавт. 1999, Матвеев Б.П. и соавт.,2001, McKiernan J.M et al, 1996, Mebust W.K., et al, 1989, Reynard J. et al, 1992). В многочисленных работах приводятся следующие преимущества ТУР перед открытыми операциями: отсутствие рассечения здоровых тканей при подходе к патологическому очагу, надежный контроль за гемостазом, более легкое течение послеоперационного периода и сокращение периода госпитализации, возможность применения операции у пациентов пожилого и старческого возраста с выраженными сопутствующими заболеваниями (Аляев Ю.Г. и соавт., 2005, Коган М.И и соавт., 1996, Мартов А.Г. и соавт., 1997, Wendt-Nordahl G. et al., 2004, Wescott J.W, 2004). Однако накопленный многочисленный опыт данных вмешательств показал, что имеются, как интраоперационные, так и послеоперационные осложнения, в том числе и отдаленные неудовлетворительные результаты оперативного лечения. К числу осложнений относятся: кровотечение, «ТУР – синдром», неконтролируемая перфорация мочевого пузыря, из-за стимуляции запирательного нерва, неполное удаление опухоли, плохая операционная видимость и потеря ориентации при массивном кровотечении, гнойно-воспалительные заболевания органов мочеполовой системы, длительно не проходящие ирритативные симптомы (Астафьев В.В., 1985, Тоскано М.Б. и соавт., 1990, Камалов А.А. и соавт, 1999, Лопаткин Н.А. и соавт., 1997, Мартов А.Г. и соавт, 1997, Симонов В.Я., 1987, Ситдыков Э. Н. и соавт., 1990, Цариченко Д. Г., 2000).
Все вышеуказанные осложнения, заставляли вести постоянный поиск, направленный на их профилактику, максимально раннее выявление и наиболее рациональное лечение. Результатом этих исследований явилось появление на свет трансуретрального выпаривания как модификации трансуретральной резекции. Первое сообщение о клиническом применении трансуретрального электровыпаривания в ликвидации инфравезикальной обструкции обусловленной доброкачественной гиперплазией предстательной железы появилось в 1994 году на Всемирном конгрессе Ассоциации эндоурологов в Сент-Луисе, США. В настоящее время именно комбинированное применение трансуретральной электрорезекции и электровапоризации успешно применяется большинством хирургов для удаления больших гиперплазий предстательной железы и поверхностных опухолей мочевого пузыря.
Однако, наряду с хорошим гемостатическим эффектом у комбинированной монополярной хирургии имеются и недостатки, как, например, глубокое термическое повреждение тканей, что затрудняет применение данного метода у больных опухолью мочевого пузыря при близком расположении опухоли к устью и в проекции запирательного нерва; невозможность применения данного метода у больных с кардиостимулятором; при гиперплазии больших размеров, что связано с ограничением времени проведения операции, обусловленным высоким риском развития ТУР – синдрома (Аляев Ю.Г. и соавт., 2005, Кириллов С.А., 2004, Лопанкин Н.А., 1997, Мартов А.Г., 1997, Цариченко Д.Г., 2000).
С момента появления в 1998 году биполярной трансуретральной резекции у хирургов расширился арсенал методов электрохирургического лечения. Принципиальное отличие биполярного от монополярного электрического воздействия заключается в том, что ток при нём не проходит через весь организм больного, а ограничивается расстоянием между электродами (активным и пассивным).
 Для создания разряда между электродами применяется электропроводящая среда (0,9 % раствор NaCl). Использование данного ирриганта позволяет выполнить операцию без ограничения времени резекции, что особенно важно при гиперплазиях больших размеров (Аляев Ю.Г. и соавт., 2005, Bishop P., 2003, Jepsen J.V. et al, 1998, Monga M. и соавт. 2002, Wescott J., 2004). Биполярной метод использует радиочастотную энергию для конвертирования электропроводящей жидкости в плазменное поле, состоящее из высокоионизированных частиц, которое разрушает молекулярные связи в структуре ткани. Необходимое воздействие на ткань проводится с использованием технологии «кобляции», которая позволяет проводить резекцию и одномоментно осуществлять гемостаз при более низких температурах (Bishop P., 2003, Jepsen J.V. et al., 1998, Yang S. et al., 2004). При проведении операции с использованием этого оборудования температура ткани находится в диапазоне 40-70С; при использовании традиционных электрохирургических методов температура ткани выше 400С. ( Аляев Ю. Г. и соавт., 2005, Beiko D. T. et al, 2004, Yoo T. K. et al, 2004 ). При более низких температурах, ткани, в том числе окружающие, получают меньше побочных тепловых повреждений, и как следствие при проведении гистологических исследований обнаруживается меньшее количество некроза резецированной ткани, что существенным образом облегчает работу морфологам и способствует более точной постановке диагноза (Wang D.S. et al., 2004).
Для создания разряда между электродами применяется электропроводящая среда (0,9 % раствор NaCl). Использование данного ирриганта позволяет выполнить операцию без ограничения времени резекции, что особенно важно при гиперплазиях больших размеров (Аляев Ю.Г. и соавт., 2005, Bishop P., 2003, Jepsen J.V. et al, 1998, Monga M. и соавт. 2002, Wescott J., 2004). Биполярной метод использует радиочастотную энергию для конвертирования электропроводящей жидкости в плазменное поле, состоящее из высокоионизированных частиц, которое разрушает молекулярные связи в структуре ткани. Необходимое воздействие на ткань проводится с использованием технологии «кобляции», которая позволяет проводить резекцию и одномоментно осуществлять гемостаз при более низких температурах (Bishop P., 2003, Jepsen J.V. et al., 1998, Yang S. et al., 2004). При проведении операции с использованием этого оборудования температура ткани находится в диапазоне 40-70С; при использовании традиционных электрохирургических методов температура ткани выше 400С. ( Аляев Ю. Г. и соавт., 2005, Beiko D. T. et al, 2004, Yoo T. K. et al, 2004 ). При более низких температурах, ткани, в том числе окружающие, получают меньше побочных тепловых повреждений, и как следствие при проведении гистологических исследований обнаруживается меньшее количество некроза резецированной ткани, что существенным образом облегчает работу морфологам и способствует более точной постановке диагноза (Wang D.S. et al., 2004).
В настоящее время в клиническую практику внедряется несколько высокотехнологичных биполярных эндоурологических систем производства различных фирм. В их основу положен метод биполярной резекции, основные отличия прослеживаются лишь в конструкции используемых инструментов. Важно отметить, что с появлением метода биполярной трансуретральной электрорезекции стало возможным проведение эндоскопического удаления гиперплазии предстательной железы, опухоли мочевого пузыря у больных с кардиостимулятором (Долецкий С.Я. и соавт.,1980, Древаль С.В., 1999, Корнев А.И. и соавт., 1996, Королев А.В., 1994).
В январе 2004 году в урологической клинике ММА им. И. М. Сеченова начато применение биполярной трансуретральной резекции с использованием генератора ACMI Vista CTR в лечении больных доброкачественной гиперплазией предстательной железы, опухолью мочевого пузыря. За период с 2004 по февраль 2008 года трансуретральная биполярная резекция проведена 51 пациенту гиперплазией предстательной железы и 50 больным опухолью мочевого пузыря, при этом оценивались: объём простаты, показатели IPSS и Q, интраоперационная кровопотеря, время пребывания пациентов в стационаре, а также интраоперационные и послеоперационные осложнения. В группу гиперплазии предстательной железы вошли пациенты в возрасте от 42 до 82 лет и объемом предстательной железы от 30 до 140 см3. . Время их пребывания в стационаре после операции составило от 5 до 15 дней, абсолютный объём кровопотери составил 145.96±47.01 мл, длительность катетеризации 32,48±21,08 часов. Время трансуретральной резекции составило 128,61±46.2мин. Среди интраоперационных осложнений у одного больного развилось умеренное кровотечение в результате перфорации капсулы предстательной железы.
 У 1 больного на 2-3 сутки послеоперационного периода при восстановившемся после удаления уретрального катетера самостоятельном мочеиспускании развился острый простатит. В двух случаях отмечалась задержка мочеиспускания после удаления уретрального катетера. Во вторую группу вошли пациенты с опухолью мочевого пузыря. Возраст пациентов варьировал от 23 до 79 лет. Все опухоли, за исключением 8 наблюдений, носили поверхностный характер, при этом у 47 больных выявлен переходно-клеточный рак различной степени дифференцировки. В 3 наблюдениях пациенты имели установленный искуственный водитель ритма. Размер опухоли составлял от 0,5 до 4 см. В 35 наблюдениях опухоль была единичной, в 12 имела полифокальный рост. 18 больных имели образования более 3 см. Опухолевые образования располагались преимущественно на боковых стенках у 28 больных, из них в непосредственной близости от устья у 14 больных. При этом удалось резецировать стенку мочевого пузыря без повреждения устьев мочеточника и неконтролируемой перфорации мочевого пузыря. У 16 больных имелись признаки инвазии в мышечный слой по данным ультразвукового исследования, мультиспиральной компьютерной томографии и магнитно–резонансной томографии. У 8 больных морфологически была подтверждена инвазия образования в мышечный слой по данным БТУР-биопсии. Во время проведения операций практически отсутствовало кровотечение из зоны резекции, что обеспечило хорошую визуализацию. Однако при расположении опухоли на боковой стенке у 3 больных была отмечена стимуляция запирательного нерва. Необходимо отметить, что стимуляция происходила в момент резекции основания опухоли или на этапе ТУР-биопсии стенки мочевого пузыря. Для профилактики стимуляции запирательного нерва нами предложена следующая методика: ТУР мочевого пузыря при его малом наполнении в сочетании с дробным короткоимпульсным применением тока во время одного движения петли. Абсолютный объём кровопотери во время операции составил 34.25±2.5мл. Время пребывания пациентов в стационаре после операции 7,35±2,24 койко-дней.
У 1 больного на 2-3 сутки послеоперационного периода при восстановившемся после удаления уретрального катетера самостоятельном мочеиспускании развился острый простатит. В двух случаях отмечалась задержка мочеиспускания после удаления уретрального катетера. Во вторую группу вошли пациенты с опухолью мочевого пузыря. Возраст пациентов варьировал от 23 до 79 лет. Все опухоли, за исключением 8 наблюдений, носили поверхностный характер, при этом у 47 больных выявлен переходно-клеточный рак различной степени дифференцировки. В 3 наблюдениях пациенты имели установленный искуственный водитель ритма. Размер опухоли составлял от 0,5 до 4 см. В 35 наблюдениях опухоль была единичной, в 12 имела полифокальный рост. 18 больных имели образования более 3 см. Опухолевые образования располагались преимущественно на боковых стенках у 28 больных, из них в непосредственной близости от устья у 14 больных. При этом удалось резецировать стенку мочевого пузыря без повреждения устьев мочеточника и неконтролируемой перфорации мочевого пузыря. У 16 больных имелись признаки инвазии в мышечный слой по данным ультразвукового исследования, мультиспиральной компьютерной томографии и магнитно–резонансной томографии. У 8 больных морфологически была подтверждена инвазия образования в мышечный слой по данным БТУР-биопсии. Во время проведения операций практически отсутствовало кровотечение из зоны резекции, что обеспечило хорошую визуализацию. Однако при расположении опухоли на боковой стенке у 3 больных была отмечена стимуляция запирательного нерва. Необходимо отметить, что стимуляция происходила в момент резекции основания опухоли или на этапе ТУР-биопсии стенки мочевого пузыря. Для профилактики стимуляции запирательного нерва нами предложена следующая методика: ТУР мочевого пузыря при его малом наполнении в сочетании с дробным короткоимпульсным применением тока во время одного движения петли. Абсолютный объём кровопотери во время операции составил 34.25±2.5мл. Время пребывания пациентов в стационаре после операции 7,35±2,24 койко-дней.
Таким образом, опыт применения биполярной трансуретральной резекции при гиперплазии предстательной железы и опухоли мочевого пузыря продемонстрировал возможности и преимущества данного метода по сравнению с монополярной электрохирургией — хороший гемостаз; возможность использования метода у больных с кардиостимулятором, поскольку ток не проходит через тело пациента; отсутствие ТУР-синдрома при применении физиологического раствора (0,9% натрия хлорида); возможность использования данного метода у пациентов с любым объёмом гиперплазии простаты; минимальное воздействие на запирательный нерв; отсутствие термических изменений окружающих тканей, что позволяет выполнять резекцию мочевого пузыря максимально близко к устью мочеточника или даже над ним и получить достаточное количество термически неизменённого материала для морфологического исследования; сокращение времени пребывания больного в стационаре после операции; возможность применения данного метода у больных любого возраста с отягощенным интеркурентным фоном.
В заключении необходимо сказать, что применение монополярных и биполярных трансуретральных электрохирургических вмешательств у пациентов с доброкачественной гиперплазией предстательной железы, опухолью мочевого пузыря способствовало повышению эффективности и безопасности лечения данных недугов, снижению уровня интра- и послеоперационного риска, сокращению числа осложнений, времени пребывания пациентов в стационаре.
Установлены преимущества и недостатки трансуретральных пособий, разработаны показания и противопоказания к применению биполярной и монополярной хирургии, основанные на научных принципах, что позволило улучшить результаты лечения, повысить комфортность и значительным образом улучшить качество жизни пациентов.
Л. М. Рапопорт, Р.А. Калантаров, С.В. Стойлов
Урологическая клиника ММА им. И.М. Сеченова (дир.- член-корр. РАМН, проф. Ю.Г. Аляев)