Рост продолжительности жизни и старение населения в популяции приводит к росту числа пациентов, страдающих половыми расстройствами. С увеличением возраста, мужчины, имеющие эректильную дисфункцию (ЭД), испытывают не только сексуальную неудовлетворенность, но и проблемы, обусловленные симптомами нижних мочевых путей (СНМП), причиной которых чаще всего является доброкачественная гиперплазия предстательной железы (ДГПЖ). Так, вероятность наличия СНМП для мужчин 30-40 лет составляет всего 14% и увеличивается до 40% и более к 50–60 годам [1]. При этом, около 70% больных ЭД имеют нарушения мочеиспускания, ассоциированные с ДГПЖ [2]. Во многом, это связано с доказанной недавно общностью патогенеза СНМП и расстройств эрекции[3].
Рост продолжительности жизни и старение населения в популяции приводит к росту числа пациентов, страдающих половыми расстройствами. С увеличением возраста, мужчины, имеющие эректильную дисфункцию (ЭД), испытывают не только сексуальную неудовлетворенность, но и проблемы, обусловленные симптомами нижних мочевых путей (СНМП), причиной которых чаще всего является доброкачественная гиперплазия предстательной железы (ДГПЖ). Так, вероятность наличия СНМП для мужчин 30-40 лет составляет всего 14% и увеличивается до 40% и более к 50–60 годам [1]. При этом, около 70% больных ЭД имеют нарушения мочеиспускания, ассоциированные с ДГПЖ [2]. Во многом, это связано с доказанной недавно общностью патогенеза СНМП и расстройств эрекции[3].
На сегодняшний день, наиболее радикальным методом лечения тяжелых форм ЭД, резистентных к консервативной терапии, относят фаллопротезирование[4]. При указанном вмешательстве кавернозные тела полового члена замещаются на протез, делая этот этап лечения ЭД завершающим, так как пенетрационная способность у такого пациента может быть обеспечена только с помощью имплантата, а применение каких-либо других лечебных мероприятий невозможно. При этом, предметом широких дискуссий на сегодняшний день остается проблема профилактики послеоперационных осложнений фаллопротезирования.
Одним из наиболее грозных нежелательных проявлений ближайшего послеоперационного периода считается ишурия. По данным литературы, острая задержка мочи (ОЗМ) может возникать практически после любого вида оперативного лечения и малоинвазивные пособия здесь не являются исключением. Так, после операций на почке послеоперационная ишурия отмечается у 6,8-55%пациентов, при вмешательствах на органах брюшной полости она возникает у 3,8-25% оперированных, и как следствие пособий на толстой кишкезадержка мочеиспускания констатируется в 25-44,5% наблюдений[5, 6].
Существующие сведения позволяютпредположить, что не только вид оперативного вмешательства определяет риск развития послеоперационной ишурии. Р. Boyle считает, что риск ОЗМ увеличивается с возрастом, при этом наиболее важным критерием, определяющим склонность к указанному осложнению, является выраженность симптомов по шкале IPSS (Международная система суммарной оценки заболеваний предстательной железы). Во многом определяющимипараметрами, влияющими на вероятность ишурии, считаются данные урофлоуметрии, количество остаточной мочи и объем предстательной железы [7].
Безусловно, потенцирующим влиянием на вероятность возникновения послеоперационной ОЗМ может обладать премедикация (прежде всего, атропин), применение миорелаксантов, средств общей, эпидуральной и спинномозговой анестезии, а так же наркотических анальгетиков [8,9,10].Однако ответ на вопрос, какой вид обезболивания повышает вероятность возникновения ишурии в послеоперационном периоде, остается дискутабельным и в настоящее время. К примеру, D. Tabaka еtаl. отмечают, что существенной разницы в частоте ишурии после операций под общей и спинномозговой анестезией нет [11]. В то время как, N. Gonulluetаl. указывают на то, что после наркоза ишурия встречается чаще, чем после спинального обезболивания [12].
Учитывая особенности патогенеза ОЗМ в послеоперационном периоде, с целью профилактики столь грозного осложнения, возможно назначение α1 адреноблокаторов, в частности, тамсулозина [13,14, 15, 16, 17]. Однако до настоящего времени частота ОЗМ и её профилактика после фаллопротезирования никем не изучалась, что послужило причиной для проведения отдельного исследования.
Материалы и методы
С целью оценки эффективности назначения тамсулозина при профилактике послеоперационной ОЗМ в клинике урологии Первого московского государственного медицинского университета им. И.М. Сеченова проведено проспективное открытое исследование, в котором приняли участие 66 больных, подвергшихся хирургическому лечению ЭД в объеме фаллопротезирования трехкомпонентным гидравлическими имплантатами, в период с 2012 по 2016 годы.
Все хирургические пособия выполнялись под спинномозговой анестезией.Применялся какчрезмошоночный (n=47), так и подлобковый (n=19) доступы. В основную (I) группу вошли 32 человека. Указанные пациенты в периоперационном периоде получали α1-адреноблокатор – тамсулозин (омникокас) по 0,4 мг 1 разв сутки. В контрольную (II) группу включили 34 пациента, не получавшихα1-адреноблокатор.
Всем больнымв начале фаллопротезированиявыполнялось дренирование мочевого пузыря уретральным катетером Фоли 14 Сh, который оставляли на последующие 10-12 часов после операции. Цилиндры гидравлического имплантата, заместившие пещеристые тела, в завершении вмешательства активировали и оставляли наполненным на те же сроки. Кроме того, в целях недопущения кровотечения в месте установки помпы под кожей мошонки и предотвращения массивной гематомы в мошоночной зоне и подкожной области ствола полового члена во всех наблюдениях после операции применялась традиционная компрессионная повязка когезивным бинтом, покрывающим указанные локализации, сроком на 10-12 часов. Удаление катетера производили в момент снятия давящей повязки непосредственной перед ее сменой на обычную и деактивацией (опорожнением цилиндров) имплантата.
Терапия α1-адреноблокатором назначалась за 5 дней до предполагаемого хирургического лечения. Это было обосновано фармакологической особенностьютамсулозина, который на 5-й день курсового применения содержится в плазме крови на 70% больше, чем при однократном приеме препарата [20]. Пациенты продолжали прием указанногоα1-адреноблокаторана протяжении 5 дней после ФП.
Возраст больных в обеих группах был сопоставим и составил в среднем 45,2±12,4 восновной группе и 44,9±13,1 лет в контрольной (р=0,356). Всем включенным в исследование пациентам за 7 дней до операциии через 5 дней после нее выполняли урофлоуметрию, эхографиюпредстательной железы, мочевого пузыря с последующим определением объема остаточной мочи. С целью систематизации жалоб пациентов (СНМП),в те же сроки применялось анкетирование по шкале IPSS.
В исследование не включали пациентов, перенесших хирургическое лечение по поводу рака простаты и ДГПЖ, а так же больных, получавших в момент обращения в клинику α1-адреноблокаторы. ДГПЖ была выявлена у 13 (40,6%) и у 14 (41,24%) больных основной и контрольной групп соответственно (р=0,093). При этом,сумма баллов IPSS у пациентов принимавших и не принимавших α1-адреноблокатор была равна 9,6±1,2 и 9,3±2,5 баллам, соответственно (р=0,176).
Объем предстательной железы по данным ТРУЗИ у пациентов I и II групп составил 36,7±11,4 и 35,9± 10,8 см3, соответственно (р=0,147). При этом количество остаточной мочи у пациентовполучавших и не получавших тамсулозин в периоперационном периоде составило 43,5±12,9 и 42,7±13,3 мл соответственно (р=0,168). А средние значенияQmaxв I и II группах соответствовали 17,1±5,4 и 17,2±5,1 мл/сек (р=0,152).
Результаты
В ближайшем послеоперационном периоде ишурия была отмечена у 1(3,1%) пациента исследуемой группы.При этом, мочеиспускание у данного больного восстановилось после однократного дренирования мочевого пузыря уретральным катетером. В контрольной группе ишурия возникла у 5 (14,7%) пациентов, что достоверно чаще (р=0,015) по сравнению с исследуемыми, получавшими в периоперационном периоде тамсулозин. Восстановление самостоятельного мочеиспускания после однократного дренирования мочевого пузыря отмечено у 3 (60%) больных, а 1 (20%) больному потребовалось двукратная катетеризация. Еще в 1 (20%) наблюдении в течение 3 дней удалось восстановить микцию на фоне дренирования мочевого пузыря постоянным катетером, который был установлен на такой срок в связи с неудавшимися попытками восстановления мочеиспускания на 1-е и 2-е сутки после операции.
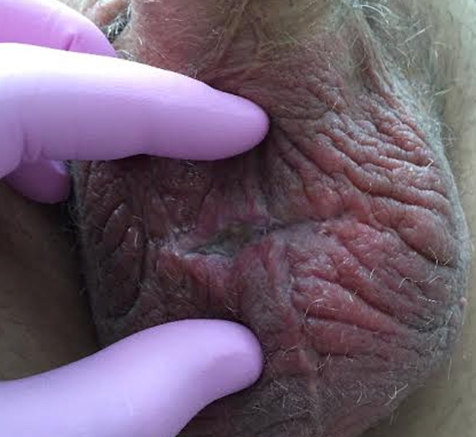
Рис.1 – Нагноение в области послеоперационной раны
В описанном наблюдении в дальнейшем отмечалось нагноение послеоперационной раны (рис.1), что потребовало более длительной (25 дней) антибактериальной терапии до момента заживления раны вторичным натяжением. Результаты сравнения субъективных и объективных параметров мочеиспускания в основной и контрольной группах через 5 дней после фаллопротезирования приведены в таблице 1.
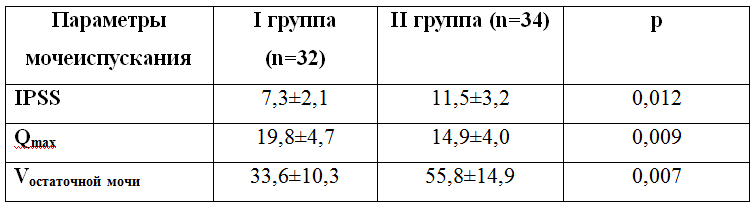
Таблица 1. Показатели мочеиспускания у пациентов I и II групп после протезирования полового члена.
Примечательно, что выраженность СНМП и объективных расстройств мочеиспусканияпосле проведенного фаллопротезированияу пациентов Iгруппы была достоверно ниже, чем у исследуемых, получавших в периоперационном периоде α1-адреноблокатор. Побочных эффектов при периоперационном приеме тамсулозина не отмечено.
Обсуждение
Любое хирургическое лечение всегда протекает на фоне повышенного тонуса симпатической нервной системы, что сопровождается увеличением выброса катехоламинов, благодаря чему возрастает стимуляция α1-адренорецепторов в области задней уретры и предстательной железы, создавая динамический компонент обструкции. В особенности, указанные процессы усугубляются после проведения уретрального катетера с целью деривации мочи. В конечном итоге, все вышесказанное может приводить к возникновению послеоперационной ишурии в сочетании с гипотонией детрузора[17].
При фаллопротезировании трехкомпонентными имплантатами, вне зависимости от вида применяемой анестезии, катетеризация мочевого пузыря выполняется облигатно в связи с необходимостью опорожнения последнего для безопасной установки резервуара в ретциево пространство[25]. Несомненно, что именно катетеризация является основным фактором, повышающим риск послеоперацоинной ишурии. В особенности указанный предрасполагающий факторреализует свое негативное влияние в сочетании с другими отягчающими обстоятельствами, касающимися расстройств мочеиспускания (СНМП, ассоциированными с ДГПЖ, неудовлетворительной Qmax и наличие остаточной мочи) [23].
Принимая во внимание полученные результаты, с целью профилактики послеоперационной ОЗМи других расстройств мочеиспусканияпосле фаллопротезирования, наиболее эффективным следует признать применение α1-адреноблокаторов. Использование тамсулозина с этой целью, с учетом его слабого влияния на гемодинамические параметры и хорошего профиля переносимости вдостаточной степеницелесообразно, в особенности, с учетом того, что протезирование полового члена чаще выполняется у пациентов старших возрастных групп[3,4,24].
По данным литературы, уретральные катетеры в 30–80% наблюдений являются входными воротами для госпитальной инфекции [18]. Известно, что после такого дренажа, на его внутренней и наружной поверхностях формируются биопленки, продуцентами которых могут быть как микроорганизмы, населяющие желудочно-кишечный тракт, так и микробы, имеющие экзогенную природу, например микрофлора кожи рук [19].В проведенном исследовании отягощающей причиной, которая вызвала инфицирование области раныв1 (2,9%)наблюдении,явилась непосредственнаяблизость расположения области доступа при фаллопротезированиик постоянному уретральному катетеру, который вынуждены были применять на протяжении 3 суток по поводу послеоперационной ишурии.Описанное осложнение обусловилоболее длительную антибактериальную терапию, заживлениеоперационного дефекта кожи вторичным натяжением и создало угрозу возникновения протезной инфекции, требующей удаления дорогостоящего имплантата без покрытия гарантией производителя.Указанная ситуация была отмечена тольков контрольной группе пациентов, не получавшей тамсулозин, что дополнительно обосновывает профилактическое назначениеα1-адреноблокаторов после протезирования полового члена.
Вывод
Назначение α1-адреноблокатора тамсулозина за 5 дней до фаллопротезирования с продолжением его приёма в течение последующих 5 дней позволяет снизить риск возникновения послеоперационной ишурии на 11,6%.Результатыпроведенногоисследования, позволяют рекомендовать назначение α1-адреноблокаторов в периоперационном периоде уописанной категории больных.
Авторы: Ахвледиани Н.Д., Матюхов И.П., Алленов С.Н., Инноятов Ж.Ш. Кафедра урологии ГБОУ ВПО (зав. – член-корр. РАН Ю.Г. Аялев) Первого МГМУ имени И.М. Сеченова, Лечебно-диагностическое отделение №4 университетской клинической больницы №2 ГБОУ ВПО Первого МГМУ имени И.М. Сеченова
Литература
1. Speakman MJ, Kirby RS, Joyce A et al. Guideline for the primary care management of male lower urinary tract symptoms. BJU Int 2004; 93: 985–90.
Braun et all. European Urology 2013; 44(5): 588-594
2. Anderson K.E. et all. NeurourologyUrodynamics 2011; 30(3) :292-301
3. Котанс А.Я. «Диагностика эректильной дисфункции, хирургическое лечение ее артериальной формы» Дисс… канд. мед. наук. Р. 2008.
4. Живов А.В. «Оценка влияния лечения эректильной дисфункции на качество жизни больных» Дисс.. канд. мед. наук. М. 2007
5. Davies A.H., Cranston D. Urinary retention after pyeloplasty Br. J. Urol. 1991 May;67(5):456-8.
6. Demirel A., Polat O., Siyez E., Bayraktar Y. Urinary retention after renal and ureteric surgery Br. J. Urol. 1993 Jul;72(l):54-5.
7. Boyle P. Some remarks on the epidemiology of acute urinary retention. Arch Ital Urol. Androl., 1998,Apr;70(2):77-82.
8. Кубариков П. Г., Давидов М. И. Острая задержка мочеиспускания. Учебно-метод. пособие, Пермь, 1992.
9. Powell P. H., Smith P. J..Feneley R.C. Bnt. J. Urol., 1980, Vol. 52, № 5,520-522.
10. Hansen B.J., Rosenberg J., Andersen J.T. Urinretentionvedpostoperativ smertebehandlingmedepiduraleopioider. Ugeskr. Laeger.,1990, May, 28; 152(22): 1574-7.
11. Tabaka D., Kemp D. Postoperative urinary retention. Part II — A retrospective study. J. Post. Anesth. Nurs. 1990.-Dec; 5(6): 397-400.
12. Gonullu N.N., Gonullu M., Utkan N.Z., Dulger M., GokgozS., KarsliВ. Postoperative retention of urine in general surgical patients. Eur. J. Surg., 1993 Mar; 159(3): 145-7.
13. Жирникова М.Л., Винаров А.З., Машковский М.Д., Пытель Ю.А. Блокаторы альфа-1-адренорецепторов в терапии больных аденомой предстательной железы. В кн. «Материалы Пленума Всероссийского общества урологов», Пермь. 1994. С. 260–267.
14. Furuya S., Kumamoto V., Vokoyama E. Dynamic aspect of obstruction hypertrophia prostatic. J. Urol. Jap. 1982;74:14–16.
15. Мазо Е. Б., Чепуров А. К., Кривобородов Г. Г., Тарасова Е. В., Маленко В. П. Фармакопрофилометрия с а-1-адреноблокаторами в диагностике динамической инфравезикальной обструкции в зоне пузырно-уретрального сегмента. Урология. 1998, № 6, с21-23.
16. Furuya S., Kumamoto V., Vokoyama E. Dynamic aspect of obstruction hypertrophia prostatic. — J. Urol. Jap. — 1982. — V. 74. — p. 14-16.
17. Мельников А.В. Послеоперационная острая задержка мочеиспускания. Дисс. канд. мед. наук. М., 2002.
18. Warren J.W. Catheter-associated urinary tract infections // Int. J. Antimicrob. Agents. 2001. Vol. 17. № 4. P. 299–303.
19. Holá V., Ruzicka F., Horka M. Microbial diversity in biofilm infections of the urinary tract with the use of sonication techniques // FEMS Immunol. Med. Microbiol. 2010. Vol. 59. № 3. P. 525–528.
20. Сивков А.В., Аполихин О.И., Толстова С.С., Карпов В.К., Ощепков В.Н., Чураков Б.И. Применение тамсулозина (омник) в качестве прогностического теста эффективности лечения ДГПЖ α1-адреноблокаторами. В кн. «Пленум правления Российского общества урологов». М., 1998. С. 240–241.
21. Перепанова Т.С. Значение инфекций, обусловленных образованием биопленок, в урологической практике. «Эффективная фармакотрепия. Урология и Нефрология» №4 (37) 2013
22. Warren J.W. Catheter-associated urinary tract infections // Int. J. Antimicrob. Agents. 2001. Vol. 17. № 4. P. 299–303.
23. П.И.Раснер, Д.Ю.Пушкарь. Медикаментознаятерапияубольныхаденомойпредстательнойжелезыигиперактивныммочевымпузырем.ConsiliumMedicum 2011; 7:12-15
24. Michel M.C. et al. The pharmacokinetic profile of Tamsulosin oral controlled absorption system. Eur. Urol. 2005;(Suppl. 4):15–24.
25. Ectopic Reservoir Placement—No Longer in the Space of Retzius Paul E. Perito, MD Perito Urology, Coral Gables Hospital, Miami, FL, J Sex Med 2011;8:2395–2398