Рак предстательной железы (РПЖ) сохраняет лидирующее положение среди опухолей, встречающихся у мужчин, как в Европе, так и в России. К настоящему времени уровень заболеваемости РПЖ в России превысил 30 случаев на 100 тыс. мужского населения [1,2]. Подавляющее большинство опухолей предстательной железы (ПЖ) у взрослых представляют собой обычную ацинарную аденокарциному. Другой вариант РПЖ – протоковая аденокарцинома [3]. Изолированная протоковая аденокарцинома составляет около 0,2–0,8 % случаев простатических аденокарцином [4] и обычно располагается центрально вокруг простатической части уретры [3, 5]. Значительно чаще (около 5 %) опухоль встречается в периферической зоне, где она сочетается с обычной ацинарной карциномой [6]. В классификации ВОЗ 2004 г. протоковая аденокарцинома определена как подтип аденокарциномы, состоящий из крупных желез, выстланных высокими псевдостратифицированными цилиндрическими клетками [3].
Первоначально этот вариант рака был описан M. M. Melikow и M. R. Pachter с использованием термина «эндометриальная аденокарцинома», потому что морфологическая картина этого подтипа напоминает рак эндометрия, и Melikow и Pachter предположили, что морфологические проявления и частая локализация опухоли около простатического бугорка указывают на происхождение ее из остатков мюллерова протока маточки и эти опухоли эстрогензависимые [7]. Однако в дальнейшем от этой гипотезы отказались, так как опухоль реагирует на гормональное лечение, а данные иммуногистохимического (ИГХ), ультраструктурного и гистохимического исследований свидетельствуют о простатическом происхождении протоковой аденокарциномы. В настоящее время термин «эндометриальная» использовать не рекомендуется.
Этот вариант рака характерен для мужчин старшего возраста [8]. Клинические симптомы изолированного протокового рака и смешанной протоково-ацинарной аденокарциномы частично совпадают [6]. При локализации опухоли вокруг уретры характерны симптомы гематурии и обструкции. В некоторых случаях аденокарцинома определяется при пальцевом ректальном исследовании. Повышенный уровень простатического специфического антигена (ПСА) встречается более чем в половине случаев и обычно связан с периферической ацинарной аденокарциномой [8]. При уретроцистоскопии протоковая аденокарцинома может выглядеть как множественные рыхлые, крошащиеся полиповидные червеобразные белые массы, выступающие из протоков или у устья маточки простатического бугорка. Однако очень часто какие‑либо специфические признаки отсутствуют [9].
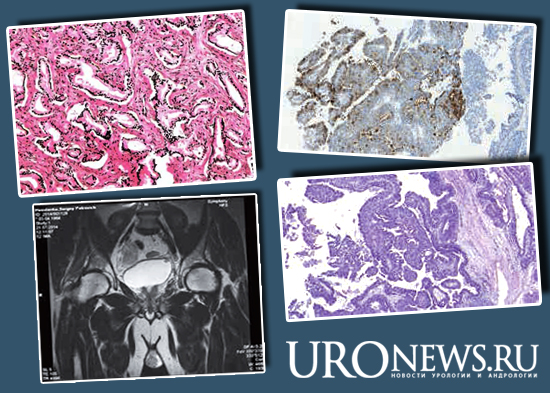
Гистологически протоковый рак обычного типа представлен комплексами сосочков или анастомозирующих желез, криброзными или солидными структурами из цилиндрического эпителия с ядерной псевдостратификацией. Папиллярные и криброзные структуры протоковой карциномы сосуществуют в половине случаев, и в обоих компонентах наблюдаются выраженная ядерная атипия, нуклеомегалия и частые фигуры митозов. Цитоплазма опухолевых клеток обильная, амфофильная, эозинофильная или светлая. В отличие от высокой простатической интраэпителиальной неоплазии (ПИН) криброзные структуры протоковой карциномы в большинстве случаев не имеют базально-клеточного слоя. Протоковый рак может быть представлен комедокарциномой, которая характеризуется наличием в просветах некроза, окруженного злокачественными клетками с высоким уровнем митотической активности, и очень похож на комедо-карциному молочной железы [3, 5, 6, 8].
При ИГХ-исследовании протоковая карцинома в большинстве случаев экспрессирует PSA, PSAP и рацемазу, прерывистый базально-клеточный слой выявляется в 30 % случаев, может выявляться фокальная экспрессия CEA, CK7, CK20, значения Ki-67 высокие. Маркер CDX2 дает положительную реакцию очень редко [3, 5, 6, 8].
Материалы и методы. Приводим 3 клинических случая протокового РПЖ у пациентов, наблюдающихся в нашем Центре (см. таблицу). Пациент М., 1957 г. р., обратился к урологу по месту жительства с жалобами на эпизоды гемоспермии, периодически беспокоящие его с 2009 г. По данным обследований установлен диагноз: доброкачественная гиперплазия предстательной железы (ДГПЖ). В связи с интермиттирующей гематурией 14.11.2013 проведена трансуретральная резекция (ТУР) ДГПЖ. Гематурия сохранялась, и 24.02.2014 повторно проведена ТУР образования в области задней уретры. Гистологическое заключение по материалам ТУР: ткань ПЖ с комплексами низкодифференцированного переходноклеточного рака. Больному начат курс полихимиотерапии (ПХТ) по схеме гемзар / цисплатин, процедуры проведены в 1, 2 и 8‑й дни цикла. Пациент обратился в МРНЦ г. Обнинска.
Результаты обследования пациентов с дуктальной карциномой ПЖ
При комплексном обследовании в МРНЦ были получены следующие результаты: ПСА общий (25.03.14) – 0,6 нг / мл; свободный / общий – 11,6 %; в общем анализе крови (25.03.14) уровень гемоглобина снижен до 119,0 г / л; по данным биохимического анализа крови, уровень железа 5,5 мкмоль / л. Остальные показатели в пределах нормы. По результатам магнитно-резонансной томографии (МРТ) малого таза образование мочевого пузыря не подтверждено. МР-картина заболевания ПЖ Т3b: структура железы неоднородная, многоузловая; наружный контур, преимущественно слева, деформирован с экстрапростатическим распространением через фасцию Денонвилье, деформируя стенку прямой кишки, без нарушения ее целостности. Семенные пузырьки инфильтрированы. Объем железы – 158 см3. По ходу общих и наружных подвздошных сосудов с обеих сторон единичные лимфатические узлы (ЛУ) до 19 мм. Изменений костных структур в зоне исследования не выявлено (рис. 1 и 2).
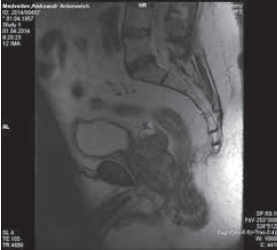
Рис. 1. Пациент М. МР-картина местно-распространенного протокового РПЖ
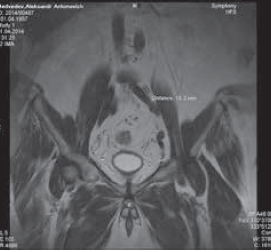
Рис. 2. Пациент М. МР-картина подвздошной лимфаденопатии
Пациенту выполнена многоместная биопсия ПЖ 01.04.2014. Гистологическое заключение: инвазивный рост протоковой аденокарциномы солидного строения, сумма баллов по шкале Глисона (индекс Глисона) 10 (5+5) с очагами некроза. На основании полученных данных пациенту был поставлен диагноз: РПЖ сТ3bN1M1а. С апреля 2014 г. начата гормонотерапия аналогами лютеинизирующего гормона рилизинг-гормона (ЛГРГ). С апреля 2015 г. пациент начал отмечать тянущие боли в промежности, ухудшение мочеиспускания. При обследовании в МРНЦ выявлен местный рост РПЖ на фоне сохраняющегося низкого уровня ПСА (0,26 нг / мл) и кастрационного уровня тестостерона. Пациенту рекомендовано проведение 6 циклов химиотерапии доцетакселом 75 мг / м2 с последующим контролем МРТ и решением вопроса о проведении курса дистанционной лучевой терапии на ПЖ, семенные пузырьки, ЛУ таза.
Пациент Е., 1955 г. р., история болезни № 5878 / 14, обратился за консультацией в МРНЦ г. Обнинска 30.06.14. Основными жалобами являлись наличие интермиттирующей гематурии, а также учащенное мочеиспускание. Из анамнеза: по месту жительства в 2011 г. проводилась биопсия ПЖ, по данным выписки: материал биопсии без признаков роста клеток рака. В связи с сохраняющейся гематурией 17.01.2014 проведена ТУР образования стенки мочевого пузыря в области его шейки. В постоперационном материале – низкодифференцированный переходно-клеточный рак. В соответствии с данными гистологического заключения и цистоскопической картины больному был установлен диагноз: рак мочевого пузыря Т3NxM0. В последующем пациенту проведено 3 цикла ПХТ по схеме гемзар / цисплатин. В связи с сохраняющейся инициальной гематурией повторно 03.06.2014 проведена ТУР образования в области семенного бугорка (цистоскопически: ворсинчатое образование с буллезным отеком без четких границ). Гистологическое заключение по материалам ТУР: ткань ПЖ с комплексами низкодифференцированного переходно-клеточного рака. По данным пересмотра гистологических материалов ТУР в МРНЦ: протоковая карцинома ПЖ, индекс Глисона 9 (4+5). Согласно результатам МРТ малого таза: состояние после оперативного вмешательства в области шейки мочевого пузыря и задней уретры. Результаты ультразвукового исследования (УЗИ): РПЖ Т3b. Объем ПЖ 40 см3. МР-картина РПЖ Т3b (инвазия в левые семенные пузырьки). Увеличенных ЛУ, изменений костных структур в зоне исследования не выявлено (рис. 3). Результаты остеосцинтиграфии: данных, подтверждающих специфический патологический процесс, нет. Общий ПСА 8,26 нг / мл (08.07.14); свободный / общий – 44,3 %. По данным рентгенографии органов грудной клетки патологических образований не выявлено. В общем анализе крови (17.07.14): анемия I степени (гемоглобин 105,0 г / л); биохимический анализ крови: снижение уровня железа до 6,5 мкмоль / л. Остальные показатели в пределах нормы. Пациенту была проведена диагностическая биопсия ПЖ и семенных пузырьков под УЗ-контролем трансректально, получено гистологическое подтверждение протокового РПЖ. На основании данных УЗИ, МРТ, гистологического заключения при пересмотре материала ТУР с места жительства и биопсии ПЖ пациенту поставлен диагноз: РПЖ сТ3bN0M0. Сопутствующая патология: ишемическая болезнь сердца; постинфарктный кардиосклероз (2003 г.); атеросклероз аорты, коронарных артерий; стенокардия напряжения II функционального класса; ишемическая кардиомиопатия; недостаточность кровообращения I степени; артериальная гипертензия II степени, риск IV степени; сахарный диабет 2‑го типа. Пациенту было начато гормоно-лучевое лечение: с 17.07.2014 г. бикалутамид 50 мг / сут ежедневно 1 мес; с 25.07.2014 г. гозерелина ацетат 3,6 мг, регулярно до 2 лет. С 21.07.2014 г. пациенту был проведен курс конформной лучевой терапии на область ПЖ, семенных пузырьков, разовая очаговая доза 2 Гр, до суммарной очаговой дозы (СОД) 74 Гр. Лечение перенес удовлетворительно. Отмечено купирование гематурии со 2‑й недели комбинированного лечения, повышение уровня гемоглобина в общем анализе крови до 117,0 г / л (04.08.14 г.) с последующим его восстановлением до нормальных величин. По данным контрольного осмотра пациента в сентябре 2015 г.: ПСА 0,23 нг / мл. По заключению УЗИ: ремиссия процесса в ПЖ; почки, мочевой пузырь не изменены. Продолжен адъювантный курс гормонотерапии аналогами ЛГРГ.
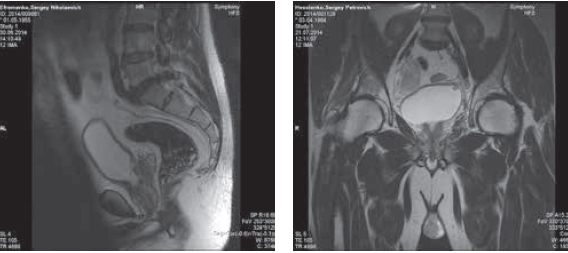
Рис. 3. Пациент Е. МР-картина местно-распространенной дукталь-
ной аденокарциномы, состояние после ТУР в области шейки мочевого
пузыря и задней уретры. Рис. 4. Пациент Х. МР-картина местно-рапространенного РПЖ, та-
зовой лимфаденопатии
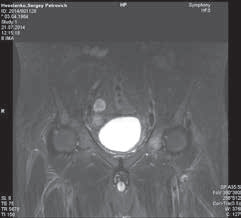
Рис. 5. Пациент Х. МР-картина метастатического поражения ко-
стей таза
Пациент Х., 1964 г. р., в связи с наличием тянущих болей в левой подвздошной и поясничной области, беспокоящих около 4 мес, обратился к урологу. По месту жительства весной 2014 г. проведено обследование. Проведено оперативное вмешательство в объеме частичной резекции забрюшинной опухоли, пересадки левого мочеточника. При пересмотре гистологических материалов резецированной опухоли в МРНЦ: фиброзно-жировая ткань с инвазивным ростом протоковой аденокарциномы, индекс Глисона 9 (4+5); общий ПСА 2,66 нг / мл (21.07.14 г.); свободный / общий – 23,4 %; раково-эмбриональный антиген 3,15 нг / мл; ß-хорионический гонадотропин человека 0,1 Ед / л; общий анализ крови (24.07.14 г.) в пределах нормы. В биохимическом анализе крови: повышение уровня мочевины – 11,2 ммоль / л, креатинина – 135 мкмоль / л, а также трансаминаз: аланинаминотрансферазы – 105 Ед / л, аспартатаминотрансферазыТ – 80 Ед / л. Выявлены положительные антитела к вирусу гепатита С. По заключению МРТ малого таза (21.07.14 г.) опухоль ПЖ с признаками экстракапсулярного распространения и вовлечением семенных пузырьков. Левосторонняя тазовая лимфоаденопатия. Очаговые изменения в костях таза (метастазы) (рис. 4 и 5). На остеосцинтиграфии (21.07.14 г.) определяются очаги патологической гиперфиксации индикатора в костях таза: в костях, образующих левую вертлужную впадину, до 152 %, в правой подвздошной кости до 125 %. По данным спиральной КТ органов грудной полости (17.06.14 г.) органических изменений не выявлено. С учетом гистологических материалов, данных МРТ и пальцевого ректального исследования пациенту выполнена многоместная биопсия ПЖ, семенных пузырьков.
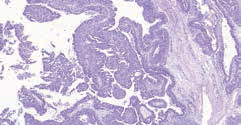
Рис. 6. Протоковый рак папиллярного строения (опухоль пациента Е.)
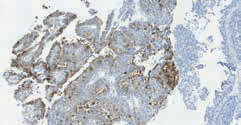
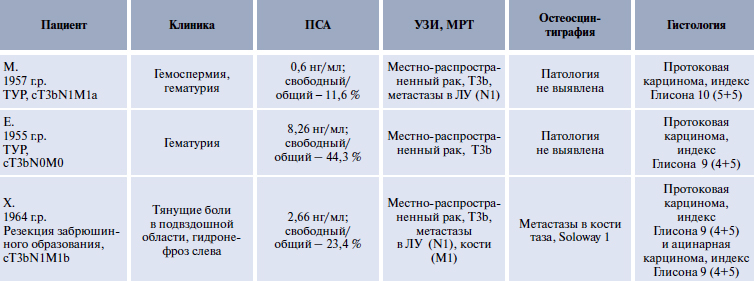
Рис. 7. Протоковый рак папиллярного строения, экспрессия PSA в опу-
холевых клетках (опухоль пациента Е.)
Гистологическое заключение: мелкоацинарная аденокарцинома, индекс Глисона 9 (4+5), имеется периневральный рост, инвазия в семенные пузырьки. На основании проведенного комплексного обследования пациенту был установлен диагноз: РПЖ сТ3bN1M1b. Сопутствующая патология: артериальная гипертензия, сахарный диабет 2‑го типа компенсированный, вирусный гепатит С.
В связи с генерализованным процессом, данными гистологического исследования метастазов в ЛУ и первичного очага пациенту начато комбинированное лечение: 24.07.2014 – фирмагон 240 мг, химиотерапия таксанами; 25.07.14 – доцетаксел 160 мг 1 раз в 21 день № 6. В последующем пациенту проведен курс конформной лучевой терапии на область ПЖ, семенных пузырьков и зоны метастазирования до СОД 74 Гр. Заключение по данным контрольного обследования в октябре 2015 г.: ремиссия процесса в ПЖ, полная регрессия со стороны ранее определяемых тазовых ЛУ, стабилизация костных метастазов. Пациент продолжает гормональное лечение аналогами ЛГРГ.
Обсуждение. Морфологическая диагностика протокового рака является сложным процессом. С одной стороны, это обусловлено относительной редкостью данной патологии и отсутствием настороженности у патологов, с другой – объективными трудностями, связанными с особенностями гистологического строения. Протоковый рак может скрываться под диагнозами ПИН, ацинарный криброзный рак, уротелиальный рак. Так, в описанных первых 2 случаях пациентам по месту жительства был поставлен морфологический диагноз: папиллярный уротелиальный рак. Опухоль у первого пациента преимущественно солидного строения, у второго – представлена преимущественно сосочковыми структурами, которые на первый взгляд действительно производят впечатление уротелиального рака. Однако типичная клиническая картина протокового рака дополняется типичным иммунофенотипом при ИГХ-исследовании: положительная реакция с PSA и PSMA, отрицательная реакция с СК7, СК20 и р63 (рис. 6, 7). Усложняют диагностику и существующие разные варианты протокового рака. Так, протоковый рак может быть представлен комедокарциномой с высоким уровнем митотической активности, похожей на комедокарциному молочной железы. В таком случае бывает сложно разграничить ее с обычной ацинарной аденокарциномой с индексом Глисона 5. В недавней работе [5] описан уротелиоподобный тип протоковой аденокарциномы, который может быть как внутрипротоковым, так и инвазивным, он, как правило, соседствует с криброзными или папил- лярными структурами. При ИГХ-исследовании уротелиоподобный тип протоковой карциномы положителен к СК7, фокально положителен к 34βЕ12, тромбомодулину и СК20, и только очагово положителен или даже отрицателен к PSA и PAP. Кистозный вариант встречается в периферической зоне, часто с экзофитным папиллярным или криброзным ростом в крупные пространства, напоминающие рост в эндометриальную полость или рост в кистозную полость при раке яичника [5].
К редким вариантам относят ПИН-подобный протоковый рак, протоковый рак с муцинозными признаками, пенисто-клеточный вариант, микропапиллярный и протоковый рак с панетоподобными нейроэндокринными клетками. Дифференциальный диагноз следует проводить с другими видами рака:
1) вторичным колоректальным раком, вовлекающим ПЖ;
2) уротелиальным раком;
3) обычным ацинарным раком;
4) криброзной ПИН.
Колоректальный рак, вторично вовлекающий ПЖ, экспрессирует CDX2 и СК20 и не экспрессирует PSA, PSMA. В уротелиальном раке выявляется коэкспрессия СК7 и СК20, р63 и отсутствие PSA, PSMA. Дуктальная карцинома значительно чаще встречается в сочетании с обычным ацинарным раком и принимается за ацинарный рак градации 4 или 5. При сочетании этих вариантов клиническая картина, как правило, соответствует ацинарной аденокарциноме с повышением уровня ПСА. Причем структуры протокового рака так же, как и ацинарного, располагаются в периферической зоне и симптомов обструкции и гематурии в таких случаях не отмечается. При гистологическом исследовании трепанобиопсии ПЖ протоковый компонент может быть представлен минимально. Так, у пациента Х. в трепанобиопсии ПЖ опухоль представлена только ацинарным компонентом, а в метастазе верифицирован протоковый компонент, который, по всей видимости, не попал в материал биопсии, но, как более агрессивный, преобладал в метастатической опухоли. При комбинированном раке протоковый компонент быстрее метастазирует, и метастазы могут быть представлены протоковым компонентом или обоими компонентами [8]. Протоковый рак – единственная неацинарная аденокарцинома, которая градируется по Глисону, и ее рекомендовано градировать по шкале Глисона градацией 4, а комедокарциному и опухоль солидного строения – градацией 5 [3]. Протоковая аденокарцинома является более агрессивной опухолью по сравнению с ацинарной аденокарциномой. По известным данным, 25–40 % пациентов на момент диагностики уже имеют метастазы, а 5‑летняя выживаемость составляет от 15 до 43 %, по данным разных авторов [3, 8]. Даже ограниченный фокус протоковой аденокарциномы в материале биопсии является основанием к проведению комбинированного лечения.
Установлено, что основным лечением дуктальной аденокарциномы являются общепринятые методы: простатэктомия при локализованном раке, гормоно-лучевое лечение при местно-распространенном и гормональная терапия при метастатическом процессе. Ряд авторов отмечают преимущество гормоно-лучевой терапии лишь перед хирургическим лечением [4, 6,10]. Так, S. Iğdem и соавт. [10] демонстрируют 3‑летнюю беспрогрессивную выживаемость по ПСА порядка 79 % в группе гормоно-лучевого лечения и 65 % у пациентов с проведенной простатэктомией. Что касается применения химиотерапии доцетакселом, в имеющейся литературе описывается ограниченное число наблюдений – не более 3 случаев [11–13]. При этом во всех 3 случаях пациенты получали доцетаксел при развитии кастрационно-рефрактерного РПЖ, в то время как 2 из 3 пациентов в нашем наблюдении химиотерапия доцетакселом была назначена в самом начале лечения в комбинации с гормональной терапией. Следует отметить, что стандарт лечения дуктальной карциномы на сегодняшний день не разработан, так как имеется очень небольшое количество наблюдений этой группы пациентов.
Заключение. Протоковая аденокарцинома является относительно редко встречающимся морфологическим вариантом аденокарциномы ПЖ, традиционно рассматривавшимся как более агрессивный вариант РПЖ, представленный распространенными формами и высокими показателями Глисона (9, 10) и не имеющий четкой схемы лечения. В отличие от ацинарной аденокарциномы, зачастую длительно не проявляющей себя, протоковый рак чаще всего демонстрирует симптомы обструкции, дизурии, а также сопровождается гематурией ввиду центральной (периуретральной) локализации. По причине гематурии и обструкции часто проводится ТУР, при которой выявляется контактно кровоточащий экзофитный компонент в области простатической части уретры с переходом на шейку мочевого пузыря. При ректальном исследовании часто можно выявить деформированную, плотную ПЖ. Данный вариант РПЖ редко проявляет себя повышенным значением ПСА, несмотря на распространенность и даже генерализацию процесса. Комбинированный РПЖ (сочетание протокового и ацинарного рака), как правило, имеет клиническую картину обычного ацинарного рака, что не позволяет его распознать, верификация возможна только при гистологическом исследовании. В диагностике важно проведение гистологического, ИГХ-исследования материала ТУР, биопсии ПЖ, семенных пузырьков. Большое значение имеют современные методы визуализации (УЗИ, МРТ) и адекватная совместная работа клиницистов, гистологов и диагностов с целью правильной интерпретации результатов обследования и выработки оптимальной тактики лечения. По данным литературы, рекомендовано хирургическое лечение при локализованных формах. Гормоно-лучевая терапия (традиционно принято было считать гормоно-лучевое лечение малоэффективным, что опровергнуто последними наблюдениями) рекомендована при местно-распространенном процессе. Наибольшее преимущество при данном варианте РПЖ имеет мультимодальный подход, позволяющий совмещать хирургическое, лучевое и химио-гормональное лечение для достижения наибольшего эффекта.
Литература:
1. Состояние онкологической помощи населению России в 2014 году. Под ред.
А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2015. [Status of cancer care facilities, provided to the population of Russia in 2014. Ed. by А.D. Kaprin, V.V. Starinsky, G.V. Petrova. М., 2015. (In Russ.)].
2. EAU guidelines on prostate cancer 2015. http://uroweb.org
3. World Health Organization Classification of Tumours. Pathology & Genetics: Tumours of the Urinary System and Male Genital Organs. Lyon, France: IARC Press, 2004.
4. Orihuela E., Green J.M. Ductal prostate cancer: contemporary management and outcomes. Urol Oncol 2008;26(4):368–71.
5. Petersen R. O., Sesterhenn I.A., Davis C.J. Urologic Pathology, 3rd ed., Philadelphia, 2009, 636 p.
6. Hertel J., Humphrey P. Ductal Adenocarcinoma of the Prostate. J Urol 2011;186:277–8.
7. Melicow M.M., Pachter M.R. Endometrial carcinoma of proxtatic utricle (uterus masculinus). Cancer 1967;20(10):1715–22.
8. Baig F.A., Hamid A., Mirza T., Syed S. Ductal and acinar adenocarcinoma of prostate: morphological and immunohistochemical characterization. Oman Med J 2015;30(3):162–6. doi: 10.5001/omj.2015.36.
9. Stajno P., Kalinowski T., Ligaj M., Demkow T. An incidentally diagnosed prostatic ductal adenocarcinoma. Cent Eur J Urol 2013;66(2): 164–7. doi:10.5173/ceju.2013.02.art14.
10. Iğdem S., Spiegel D.Y., Efstathiou J. et al. Prostatic duct adenocarcinoma: clinical characteristics, treatment options, and outcomes – a rare cancer network study. Onkologie 2010;33:169–73.
11. Fujiwaraa R., Tsurua T., Kawauchia A. et al. Metastatic prostatic ductal adenocarcinoma successfully treated with docetaxel chemotherapy: a case report. Case Rep Oncol 2015;8:339–44.
12. Kumar A., Mukherjee S.D. Metastatic ductal carcinoma of the prostate: a rare variant responding to acommon treatment. Can Urol Assoc J 2010;4:50–54.
13. Paterson C., Correa P.D., Russel J.M. Ductal variant of adenocarcinoma prostate responding to docetaxel – acase report. Clin Oncol 2010;22:617
Источник: ОНКОУРОЛОГИЯ 1’2016 ТОМ 12 CANCER UROLOGY 1’2016 VOL. 12// Авторы:
В.А. Бирюков, Н.А. Горбань, О.Б. Карякин, Д.В. Неледов, А.Д. Каприн


Ультразвуковая абляция опухолей простаты с применением трансректального фокусированного высокоинтенсивного ультразвука (HIFU) представляет собой неинвазивный метод лечения, во время которого под спинальной анестезией в прямую кишку пациента вводят трансректальный аппликатор, состоящий из УЗИ -датчика и изогнутого пьезоэлектрического кристалла, который фокусирует ультразвуковые лучи в заданной точке. Лечение проводится под ультразвуковой навигацией; абляция ткани осуществляется за счёт сочетания теплового (повышение температуры до 80—90 °C в окрестности фокальной точки) и механического (повреждение тканей при схлопывании микропузырьков, формирующихся внутри клеток под действием высокоинтенсивного ультразвука) воздействия. При лечении первичного рака предстательной железы ультразвуковую абляцию применяют либо как основной метод лечения, либо — чаще — как спасительную местную терапию при рецидивах после дистанционной лучевой терапии или хирургического вмешательства