У большинства мужчин после 40 лет имеет место снижение уровня тестостерона в сыворотке крови, а к возрасту 70 лет у 30% мужчин отмечаются признаки позднего гипогонадизма (ПГ): снижение сывороточного тестостерона, снижение либидо, депрессия, эректильная дисфункция и ощущение усталости.1,2,3 Ряд исследований показал, что заместительная терапия тестостероном (ЗТТ) эффективно уменьшает эту симптоматику4-9, однако существуют теоретические опасения, что ЗТТ может усугублять симптомы нижних мочевыводящих путей (СНМП). Хотя результаты нескольких исследований8, 10-25 свидетельствуют об обратном, до сих пор они не были подвергнуты единому анализу. Теперь такая работа в виде систематического обзора и мета-анализа проведена группой экспертов из США, и ее результаты опубликованы в журнале Европейской урологической ассоциации.
Заместительная терапия тестостероном (ЗТТ) не приводит к нарастанию суммарной оценки по шкале IPSS у мужчин с гипогонадизмом и симптомами нижних мочевыводящих путей легкой и средней степени.
Существующие данные позволяют предположить такой же эффект и у больных с СНМП тяжелой степени (IPSS>19), но для изучения влияния ЗТТ на эту группу пациентов необходимы дополнительные исследования.
Путем поиска в основных сетевых источниках информации о клинических исследованиях (MEDLINE, Embase, ClinicalTrials.gov, The Cochrane Library) были идентифицированы все публикации о ЗТТ по поводу ПГ, вышедшие в свет с января 1992 г. (когда была разработана Международная система оценки заболеваний предстательной железы – IPSS26) до сентября 2015 г. Из 1028 исследований были отобраны 14, отвечающие необходимым строгим критериям: рандомизированные, плацебо-контролируемые, с оценкой СНМП по IPSS. Общее количество пациентов, участвовавших в отобранных исследованиях, составило 2029 человек (среднее количество участников в одном исследовании – 145, разброс – 37-321), средний возраст пациентов – 64,5 г., средняя длительность наблюдения – 34,4 мес. Пять исследований были проведены в Северной Америке, четыре – в Азии, четыре – в Европе и одно – в Австралии. В пяти исследованиях критерием исключения была оценка по IPSS ≥20, в одном ≥14, и в восьми высокие показатели оценки по IPSS среди критериев исключения указаны не были. В семи исследованиях применялся тестостерон с топическим способом введения, в пяти – парентеральный, в двух – для приема внутрь. В трех исследованиях уровень тестостерона измеряли с помощью радиоиммунного метода, в трех – иммунохимически, в двух – посредством хемолюминисценции, и в одном – путем жидкостной хроматографии. Еще в двух публикациях не был указан метод определения концентрации гормона. Все исследования были оценены на уровень риска предвзятости, и он был признан низким.
Анализ показал, что не существует статистически значимой разницы между изменением оценки по IPSS между мужчинами, получавшими ЗТТ и получавшими плацебо (см. Рис. 1). Среднее изменение оценки по IPSS на фоне ЗТТ составило –0,41 балла, а на фоне плацебо +0,12 балла (р=0,11). Анализ различий между исследованиями показал, что такие факторы, как форма тестостерона, изменения в уровне простатспецифического антигена (ПСА), изменения уровней сывороточного тестостерона, изменения суммарной оценки по шкале симптомов мужского старения, на общие результаты влияния не оказывали. Это позволяет сделать вывод о том, что ЗТТ не усугубляет СНМП у мужчин с гипогонадизмом, независимо от того имеют у них место СНМП легкой степени, умеренной степени, или они отсутствуют.
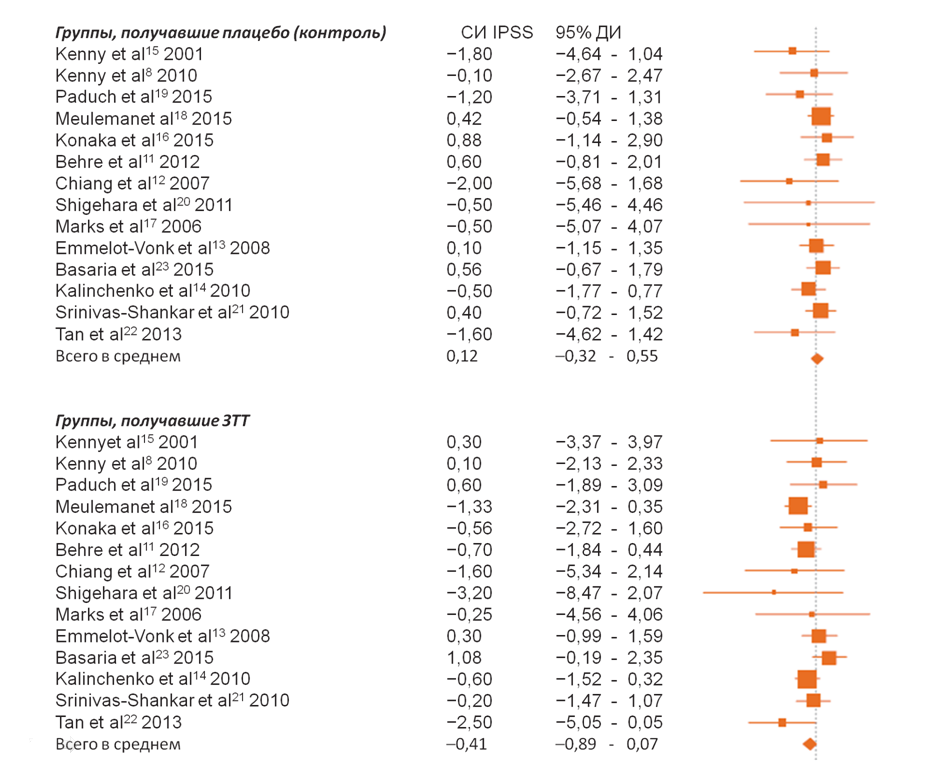
Рисунок 1. Среднее изменение суммарного балла при оценке по IPSS (СИ IPSS) у мужчин, получавших заместительную терапию тестостероном (ЗТТ) или плацебо.
Что касается пациентов с высоким суммарным баллом по IPSS, то большинство ученых склонны исключать их из исследований, т.к. применение ЗТТ при IPSS>19 не рекомендуется Практическим руководством Общества клинической эндокринологии27. Лишь в два исследования были включены мужчины с IPSS>19, однако в первой публикации22 отсутствуют результаты по динамике IPSS именно в этой подгруппе пациентов, во втором же исследовании25 среднее изменение IPSS на фоне ЗТТ у этих больных составляло –7,42 балла, что было достоверно существеннее, чем у больных с СНМП легкой и средней степени. Правда, в этой публикации не сообщается, получали ли эти пациенты фармакотерапию в связи с СНМП, поэтому нельзя заключить, следствием чего именно было уменьшение симптоматики. Можно, впрочем, предположить, что ЗТТ не усугубляет СНМП даже при IPSS>19. На эту тему опубликовано два обзора28,29, причем Seftel и соавт.28 призывают пересмотреть рекомендации Общества клинической эндокринологии в отношении ЗТТ при выраженных СНМП.
В заключение авторы мета-анализа рекомендуют провести специальное рандомизированное контролируемое исследование с целью точно установить влияние заместительной терапии тестостероном на суммарную оценку по шкале IPSS у мужчин с гипогонадизмом и СНМП тяжелой степени.
Литература
1. Feldman HA et al. Age trends in the level of serum testosterone and other hormones in middle-aged men: longitudinal results from the Massachusetts male aging study. J Clin Endocrinol Metab 2002;87:589–98.
2. Harman SM et al. Longitu- dinal effects of aging on serum total and free testosterone levels in healthy men. Baltimore Longitudinal Study of Aging. J Clin Endocrinol Metab 2001;86:724–31.
3. Schubert M, Jockenhovel F. Late-onset hypogonadism in the aging male (LOH): definition, diagnostic and clinical aspects. J Endocrinol Invest 2005;28:23–7.
4. Wang C et al. Testosterone replacement therapy improves mood in hypogonadal men–a clinical research center study. J Clin Endocrinol Metab 1996;81:3578–83.
5. Wang C et al. Transdermal testoster- one gel improves sexual function, mood, muscle strength, and body composition parameters in hypogonadal men. J Clin Endocrinol Metab 2000;85:2839–53.
6. Seidman SN, Rabkin JG. Testosterone replacement therapy for hypogonadal men with SSRI-refractory depression. J Affect Disord 1998;48:157–61.
7. Snyder PJ et al. Effects of testosterone re-placement in hypogonadal men. J Clin Endocrinol Metab 2000; 85:2670–7.
8. Kenny AM et al. Effects of transdermal testosterone on bone and muscle in older men with low bioavail-able testosterone levels, low bone mass, and physical frailty. J Am Geriatr Soc 2010;58:1134–43.
9. Dobs AS et al. Pharmacokinetics, efficacy, and safety of a permeation-enhanced testosterone transdermal system in comparison with bi-weekly injections of testosterone enanthate for the treatment of hypogo-nadal men. J Clin Endocrinol Metab 1999;84:3469–78.
10. Cui Y, Zhang Y. The effect of androgen-replacement therapy on prostate growth: a systematic review and meta-analysis. Eur Urol 2013;64:811–22.
11. Behre HM et al. A randomized, double-blind, placebo-controlled trial of testosterone gel on body composition and health-related quality-of-life in men with hypogonadal to low- normal levels of serum testosterone and symptoms of androgen deficiency over 6 months with 12 months open-label follow-up. Aging Male 2012;15:198–207.
12. Chiang HS et al. Transdermal testosterone gel increases serum testosterone levels in hypogonadal men in Taiwan with improvements in sexual function. Int J Impot Res 2007; 19:411–7.
13. Emmelot-Vonk MH et al. Effect of testosterone supplementation on functional mobility, cognition, and other parameters in older men: a randomized controlled trial. JAMA 2008;299:39–52.
14. Kalinchenko SY et al. Effects of testosterone supplementation on markers of the metabolic syndrome and inflammation in hypogonadal men with the metabolic syndrome: the double-blinded placebo-controlled Moscow study. Clin Endocrinol 2010;73:602–12.
15. Kenny AM et al. Effects of transdermal testosterone on bone and muscle in older men with low bioavailable testosterone levels. J Gerontol A Biol Sci Med Sci 2001;56:M266–72.
16. Konaka H et al. Effects of long-term androgen replacement therapy on the physical and mental statuses of aging males with late-onset hypogonadism: a multicenter ran-domized controlled trial in Japan (EARTH Study). Asian J Androl 2016;18:25–34.
17. Marks LS et al. Effect of testosterone replacement therapy on prostate tissue in men with late-onset hypogonadism: a randomized controlled trial. JAMA 2006;296: 2351–61.
18. Meuleman EJ et al. Effects of long-term oral testosterone undecanoate therapy on urinary symptoms: data from a 1-year, placebo-controlled, dose-ranging trial in aging men with symptomatic hypogonadism. Aging Male 2015;18:157–63.
19. Paduch DA et al. Testosterone replacement in androgen-deficient men with ejaculatory dysfunction: A random- ized controlled trial. J Clin Endocrinol Metab 2015;100:2956–62.
20. Shigehara K et al. Androgen replacement therapy contributes to improving lower urinary tract symptoms in patients with hypogonadism and benign prostate hypertrophy: a randomised controlled study. Aging Male 2011;14:53–8.
21. Srinivas-Shankar U et al. Effects of tes-tosterone on muscle strength, physical function, body composition, and quality of life in intermediate-frail and frail elderly men: a randomized, double-blind, placebo-controlled study. J Clin Endo-crinol Metab 2010;95:639–50.
22. Tan WS et al. Efficacy and safety of long-acting intramuscular testosterone undecanoate in aging men: a random- ised controlled study. BJU Int 2013;111:1130–40.
23. Basaria S et al. Effects of testosterone administration for 3 years on subclinical atherosclerosis progres-sion in older men with low or low-normal testosterone levels: A randomized clinical trial. JAMA 2015;314:570–81.
24. Pechersky AV et al. Androgen administration in middle-aged and ageing men: effects of oral testosterone undecano- ate on dihydrotestosterone, oestradiol and prostate volume. Int J Androl 2002; 25:119–25.
25. Pearl JA et al. Testosterone supplementation does not worsen lower urinary tract symptoms. J Urol 2013;190: 1828–33.
26. Barry MJ et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. J Urol 1992;148:1549–57.
27. Bhasin S et al. Testosterone therapy in men with androgen deficiency syndromes: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2010;95: 2536–59.
28. Seftel AD et al. Critical update of the 2010 Endocrine Society Clinical Practice Guidelines for Male Hypogonadism: A systematic analysis. Mayo Clin Proc 2015;90: 1104–15.
29. Kathrins M et al. The Relationship between Testosterone Replacement Therapy and Lower Urinary Tract Symptoms: A systematic review. Urology. In press. http://dx.doi.org/10.1016/j.urology.2015.11.006.
Источник: Kohn TP et al. Effects of Testosterone Replacement Therapy on Lower Urinary Tract Symptoms: A Systematic Review and Meta-analysis. Eur Urol. 2016 Feb 10. [Epub ahead of print].