Ишемическая болезнь предстательной железы как одна из причин урологического синдрома хронической тазовой боли
М.И.Коган, И.И.Белоусов, А.В.Шангичев
Кафедра урологии ФПК и ППС, отделение урологии Клиники РостГМУ, Ростов-на-Дону
«Простатит – настоящая головоломка в урологии; группа состояний, которые чрезвычайно распространены, плохо понимаемы, неадекватно лечены и недостаточно исследованы».
Daniel A.Shoskes, Eric A.Klein. (Cleveland, Ohio. 2008)
 Проблема диагностики и лечения абактериального хронического простатита (ХП) как одной из составляющих урологического синдрома хронической тазовой боли (СХТБ) приобретает в современной урологии все большую актуальность. Единого мнения о природе этой патологии в современной урологии не выработано.
Проблема диагностики и лечения абактериального хронического простатита (ХП) как одной из составляющих урологического синдрома хронической тазовой боли (СХТБ) приобретает в современной урологии все большую актуальность. Единого мнения о природе этой патологии в современной урологии не выработано.
Пациенты с тазовой болью – сложная категория хронических больных. Они, как правило, в той или иной мере социально дезадаптированны длительно и с малым успехом, а зачастую безуспешно, посещают врача. Практически всегда трудны для диагностики и лечения и страдают от сниженного качества жизни.
Новая эра в изучении абактериального ХП началась с момента принятия урологами новой классификации ХП Национального института здоровья США (рассмотрена в 1995 г., опубликована в окончательном варианте в 1999 г.). Проводимые исследования привели к качественным изменениям в диагностике этого состояния, что в свою очередь оказало влияние на увеличение пациентов с тазовым болевым синдромом на приеме у уролога. Их обращаемость еще более возросла с введением в практическую повседневную деятельность урологов стандартизованной анкеты индекса симптомов ХП (NIH-CPSI).
Как показывает практика, простатит является самым общим урологическим заболеванием у мужчин моложе 50 лет и третьим по счету общим урологическим диагнозом у мужчин старше 50 лет (после доброкачественной гиперплазии предстательной железы и карциномы простаты), составляя 8% обращений в урологические отделения [1]. На основе данных медицинского отчета, подготовленного в графстве Дэйн (штат Висконсин), и отчета, подготовленного молодыми специалистами медицинского подразделения Национальной гвардии штата Висконсин [2)], было подсчитано, что 5% молодых мужчин в возрасте от 20 до 50 лет имеют диагноз «простатит». В Нидерландах J.De la Rosette и соавт. [3] отметили, что у 4% опрошенных мужчин диагностирован простатит. В обзоре, подготовленном R.Roberts и соавт. [4] на основе просмотра медицинских карт 2113 мужчин за период с июля 1992 по февраль 1996 г. (почти 50-месячный отрезок времени), проживающих в поселках графства Ольмстед (штат Миннесота), отмечено, что распространенность врачебного диагноза «простатит» составляет 11%.
M.Marszalek и соавт. в 2007 г. были опубликованы данные, демонстрирующие распространенность симптомов СХТБ у населения: при опросе 1765 здоровых мужчин (возрастной интервал 20–79 лет) вне зависимости от возраста симптомными по анкете индекса симптомов ХП (NIH-CPSI) являлись 16,4% респондентов. Но интенсивность болевого синдрома при этом имела прямую зависимость от возраста пациентов: в группе до 29 лет симптомы имели умеренную и легкую степень выраженности, в то время как у пожилых мужчин (70–79 лет) интенсивность симптоматики была более высока. Оценка же структурности ответов свидетельствовала о некой субъективности в оценке симптомов. Так, некоторые респонденты не обращали внимания на симптомы, кто-то считал их естественными проявлениями старения и оценивал себя здоровым человеком, таковым не являясь.
В практической урологии на сегодняшний день (согласительное мнение Международной конференции по ХП/СХТБ категории III, Giessen, Германия, 2002) не существует общепринятых критериев диагностики СХТБ, тем более дифференциации воспалительной (III А) и невоспалительной (III Б) форм между собой. Проявление признаков воспаления простаты при категории IIIA мало отличается от симптомов больных с невоспалительным заболеванием простаты категории III Б.
В этом контексте важно понимание того, что ХП/СХТБ крайне редко является моносимптомом, а симптомы воспалительного (категория III A) и невоспалительного (категория III Б) ХП/СХТБ не отличаются друг от друга, равно как и не обладают специфичностью (J.Krieger, L.Nyberg, J.Nickel, 1999). Выделяется главенствующая триада симптомов:
1. Боль (в промежности, надлонной области, половом члене, области крестца, в паху или нижней части спины, во время или после эякуляции). В зависимости от ее интенсивности могут проявляться симптомы депрессии той или иной степени выраженности.
2. Симптомы со стороны нижних мочевых путей (СНМП).
3. Эректильная дисфункция (ЭД).
В уже цитированной нами работе M.Marszalek и соавт. (2007 г.) представлены данные о корреляции тяжести СНМП с возрастом и статистически достоверной положительной зависимостью боли с симптомами II фазы миктурического цикла (p=0,02). Но достоверной связи боли с симптомами I фазы миктурического цикла не показано. Индекс оценки эректильной функции (анкета IIEF) имел сильную обратную зависимость как с общим счетом симптомов по опроснику ХП (NIH-CPSI), так и по отдельности с болью, мочевыми симптомами и качеством жизни.
H.Schneider, H.Wilbrandt, W.Weidner, E.BrКhler (Justus-Liebig University of Giessen, University of Leipzig, Германия, 2007 г.) обнаружили при оценке 36 больных с СХТБ III А и 103 пациентов с СХТБ III Б ЭД в 47% случаев: 15,9% легкой, 9,5% умеренно легкой, 41,4% умеренной и 22,2% тяжелой степени. У пациентов с СХТБ III Б в 71,8% наблюдений отмечено ЭД.
Помимо того, в клинической картине ХП/СХТБ можно выделить и системные симптомы. Усталость, боль и ощущение беспомощности, непропорциональные данным физикального обследования, связь со стрессом и психологическими факторами сходны с симптомами, наблюдаемыми при других плохо объяснимых клинических состояниях, включая фибромиалгию, синдром раздражения кишечника и синдром хронической усталости [5]. В недавнем исследовании J.Potts и соавт. функциональные соматические синдромы и психологические нарушения оказались достоверно более распространены у мужчин с ХП/СХТБ по сравнению с популяцией в целом [6]. Таким образом, растет понимание того, что ХП/СХТБ может быть проявлением одного из этих соматических синдромов или более [7].
Однако стандартизованные исследовательские тесты не позволяют диагностировать причину СХТБ, а скорее исключают иные патологические состояния (например, гиперплазия простаты).
Согласно определению Международной ассоциации по исследованию боли (IASP, 1988), «…боль – это неприятное ощущение и эмоциональный опыт, связанные с текущим потенциальным повреждением ткани или описанные в таких терминах, как описывается повреждение».
В 2004 г. в когортном исследовании пациентов (n=463) с СХТБ под эгидой NIH (США) было показано, что интенсивность боли является самым значимым показателем, влияющим на качество жизни больных с ХП/СХТБ, после связанных с возрастом мочевых симптомов, показателей депрессии и состояния партнера. Эти данные важны для клинического ведения СХТБ. Хотя неоднократно обсуждалось, что боль является первичным симптомом при СХТБ [8, 9] и должна быть хронической [10], никакие предшествующие исследования не показали, как боль могла бы изменить качество жизни и какие физические и психологические факторы могли бы лучше всего сформировать картину боли. Кроме того, выраженность боли четко коррелирует с депрессивными симптомами, вне связи с симптомами со стороны нижних мочевых путей и возрастом.
Согласно M.Cepeda, M.Cousins, D.Carr (2008 г.), этиологическими факторами боли являются опухолевый процесс, ишемия и послеоперационное состояние тканей. При этом по типу различают ноцицептивную, нейропатическую, висцеральную и соматическую боль.
Наиболее вероятными механизмами формирования боли являются:
1. Воспаление.
2. Центральная сенсибилизация.
3. Спраутинг механорецепторных волокон в задних рогах.
4. Спраутинг норадренергических аксонов вокруг чувствительных нейронов в ганглиях задних корешков.
5. Патологические связи во вновь образованных соединениях в ранее разделенных проводящих путях.
Применительно к абактериальному ХП доказано, что воспаление и инфекция не коррелируют с тяжестью симптомов [11–14], т.е. иные факторы определяют клинику, а проводимое стандартное лечение приводит лишь к небольшому облегчению и далеко не у всех пациентов. Степень восприятия боли неадекватна обнаруженному обычными средствами повреждению тканей, но лишь в редких случаях боль является нестерпимой. Пациенты имеют многолетний анамнез болезни, однако при их обследовании не выявляются органические изменения.
Но если «…частота обнаружения микроорганизмов при ХП III и у здоровых неотличима друг от друга (8%), то тогда проба Мирса–Стеми имеет сомнительную клиническую значимость» (C.Nickel и соавт., 2002). Кроме того, «…нет различий между ХП (35%) и контролем (36%) в частоте положительных культур биопсии и типах бактерий, изолированных из биоптатов. Все бактерии простаты являются комменсалами в уретре» (J.Jee и соавт., 2003). Что же тогда обусловливает боль? Какие факторы являются причиной и механизмом ее развития?
В 2003 г. нами была инициирована исследовательская программа по следующим направлениям:
1. Оценка и взаимосвязь симптомов у пациентов с ХП/СХТБ форм III А и III Б.
2. Диагностика микробной обсемененности секрета простаты у пациентов с ХП/СХТБ категории III и здоровых добровольцев.
3. Оценка биохимического статуса (антиоксидантная, калликреин-кининовая системы, энергетический метаболизм) сыворотки крови и секрета простаты у пациентов с ХП/СХТБ категории III и здоровых добровольцев.
4. Оценка артериальной гемодинамики простаты и таза у пациентов с ХП/СХТБ категории III и здоровых добровольцев.
5. Патоморфологическое исследование ткани простаты (включая иммуногистохимию и электронную микроскопию) у пациентов с ХП/СХТБ категории III.
В общей сложности за этот период времени нами были изучены более 200 пациентов с подтвержденным стандартными методами обследования диагноза ХП/СХТБ категории III в возрастном интервале от 18 до 50 лет с длительностью болезни от 6 мес до 14 лет. В качестве контроля оценены результаты аналогичных исследований, выполненных у молодых людей-добровольцев в возрасте 18–30 лет, не имеющих анамнестических и клинических данных, свидетельствующих о какой бы то ни было патологии органов и систем организма.
Симптомы
Симптоматология изучена у 125 пациентов с СХТБ III, из них с воспалительной формой СХТБ (ХП/СХТБ III А) 74 пациента, с невоспалительной (ХП/СХТБ III Б) – 51 пациент.
В качестве инструмента оценки использованы валидные анкеты – опросники хронического простатита (NIH-CPPS), симптомов со стороны НМП (I-PSS) и эректильной функции (IIEF).
Достоверно более высокую интенсивность боли отметили пациенты с ХП/СХТБ III Б. Эти же больные оценили проблемы с мочеиспусканием как более значимые в сравнении с пациентами с ХП/СХТБ III А. При этом в группе c невоспалительным СХТБ превалировали симптомы нарушения I фазы мочеиспускательного цикла против симптомов II фазы мочеиспускательного цикла у пациентов с СХТБ III Б. Однако статистической достоверности при сравнении структурности симптомов нарушения мочеиспускания в группах получено не было (табл. 1).
Взаимосвязь боли и количества лейкоцитов в секрете простаты была оценена путем сопоставления данных анкеты хронического простатита и результатов микроскопии секрета простаты у 112 пациентов с СХТБ III А и 128 пациентов с СХТБ III Б. Оказалось, что количество лейкоцитов в секрете простаты достоверно не связано с индексом болевого синдрома (рис. 1).
Важно подчеркнуть, что уровень боли, будучи идентичным при воспалительной и невоспалительной формах синдрома тазовой боли, сопровождался разным достоверным уровнем лейкоцитов в простатическом секрете. Этот показатель никоим образом не отличался при сравнении невоспалительной формы синдрома с контролем.
Путем выполнения газожидкостной хроматографии секрета простаты и исследования в нем метиловых эфиров высших жирных кислот было обнаружено, что секрет простаты пациентов с воспалительной формой СХТБ в сравнении с контролем содержит от 3,7 до 5,5% жирных кислот бактериальной природы (p<0,001). В то же время у пациентов с III Б и в контрольной группе эти показатели не превышали 2 и 1,2% соответственно (p>0,2).
Таким образом, было установлено, что роль воспалительного процесса как фактора, формирующего боль в тазе, при СХТБ не велика. Иные факторы ответственны за наличие симптоматики СХТБ, не имеющей специфичности в группах. Но клинические проявления СХТБ более выражены у пациентов с ХП/СХТБ III Б.
Биохимия сыворотки крови и секрета простаты у пациентов с ХП/СХТБ
Несмотря на то что боль является субъективным симптомом, существует ряд биохимических показателей, оценивая которые можно судить о боли. Нами изучены:
1. Калликреин-кининовая система (ККС) – важнейшая физиологическая адаптационная система организма. Ее активация приобретает ключевое значение при возникновении процессов воспаления. Калликреин – основной фермент ККС. Он переводит кининоген в брадикинин – мощный вазодилататор и медиатор боли и воспаления.
По результатам оценки ККС в сыворотке крови больных с СХТБ было выявлено увеличение калликреина, снижение прекалликреина и разнонаправленные изменения a1-протеиназного ингибитора (рис. 2). В случае с III А демонстрируются компенсаторные изменения и сбалансированный кининогенез, в то время как при III Б происходит декомпенсация кининогенеза. При оценке активности ККС простатического секрета наблюдаются иные закономерности: декомпенсация кининогенеза в группе III Б становится более выраженной, но при форме III А носит массивный характер (рис. 3). И если в случае с III Б происходит просто активация ККС, то при III А – «атака» ККС. Клинически эффекты действия ККС реализуются через отек интерстиция, спазм гладкой мускулатуры и боль.
2. Активность некоторых компонентов антиоксидантной защиты крови (АОЗ) – охранной системы организма, препятствующей повреждению мембран клеток и накоплению синглетного кислорода. К ключевым ферментам антиоксидантной системы организма относятся: супероксиддисмутаза (СОД), катализирующая реакцию дисмутации супероксидного анион-радикала до перекиси водорода и каталаза (Кт), утилизирующая перекись водорода [15, 16]. Это непосредственно первая линия ферментативной защиты. Существует мнение, что эти два фермента составляют взаимозащищающую пару (Emersly, 1984). Но они выполняют свою функцию только тогда, когда находятся в состоянии «рабочего баланса» как в условиях нормы, так и в условиях патологии (Mavelli и соавт., 1982).
В нашем исследовании при оценке СОД и Кт в сыворотке крови мы не отметили никаких изменений ферментов у исследуемых и контрольной групп (рис. 4), что свидетельствует о сбалансированности АОЗ.
В секрете простаты повышенная активность Кт при III А (до 125%) демонстрирует наличие окислительного стресса, а снижение активность Кт при III Б (до 46%) свидетельствует только об его инициации (рис. 5). В любом случае «инициатором» действия АОЗ в секрете простаты является гипоксия и окислительный стресс.
3. Уровень энергетического метаболизма. Для оценки его активности мы изучали показатели лактатдегидрогеназы (ЛДГ) и отношение лактат/пируват в сыворотке крови и секрете простаты. Результаты исследования показали, что пациенты с СХТБ III испытывают гипоксию. Так, например, мы обнаружили повышение отношения лактата к пирувату и снижение уровня ЛДГ. Более выраженные изменения были отмечены у пациентов с III Б, что указывает на высокий уровень тканевой гипоксии и ишемии. Более мягкие изменения этих параметров в группе IIIA объяснимы умеренной гипоксией на фоне адаптационных реакций.
Оценка энергетического метаболизма в простатическом секрете выявила повышение уровня лактат/пируват, но уже с незначительным снижением ЛДГ у пациентов с III Б, что свидетельствует об адаптационно-компенсаторном состоянии реакций (рис. 6, 7).
4. Состав липидов сыворотки крови. Как известно, одной из возможных моделей реализации боли является гипоксия, например вследствие дефицита притока артериальной крови по причине атеросклеротических изменений стенки артерий. С целью поиска признаков раннего атеросклероза исследуемому контингенту выполнены липидограммы крови. Анализируемые показатели в группе III А и контроле оказались достоверно сравнимы между собой (p<0,05). В то же время в группе III Б у всех пациентов определена гиперлипидемия типа II А (общий холестерин – ХС – 6,01±0,4 ммоль/л, p<0,001; ИА – 4,25±0,9, p<0,006). Остальные исследуемые диагностические параметры не имели достоверной статистической разницы в обеих группах (табл. 2).
Ранее было установлено, что вариант липопротеинемии II А проявляется ишемической болезнью сердца и инфарктом миокарда в сравнительно молодом возрасте. Сущность генетического дефекта, лежащего в основе варианта А, сводится к дефициту рецепторов липопротеинов низкой плотности – ЛПНП (в первую очередь к дефициту печеночных рецепторов), что резко затрудняет элиминацию ЛПНП из плазмы крови и способствует значительному подъему концентрации ХС и ЛПНП в крови. Можно предположить, что данный механизм лежит в основе развития ишемии тазовых органов и болевого синдрома и у больных с ХП III. Выявленные нарушения липидного обмена, являясь признаками атерогенеза, по всей видимости, являются одним из возможных этиопатогенетических факторов, приводящих опосредованно к развитию болевого синдрома у пациентов с ХП/СХТБ III Б.
В связи с этими фактами нами в 2008 и 2009 гг. проведен ряд исследований по оценке взаимосвязи тазовой боли, ЭД, ЭД у пациентов с ранее выявленными в клинике сосудистой хирургии системными нарушениями артериальной и венозной гемодинамики таза и нижних конечностей [17].
Так, при анализе 53 пациентов с хронической артериальной недостаточностью (системный атеросклероз) и нарушениями венозного оттока (варикозная болезнь и посттромбофлебитический синдром) нижней половины туловища было продемонстрировано, что артериальная и венозная патологии таза с высокой частотой сопровождается как СНМП, так и СХТБ. Частота и интенсивность боли и миктурические симптомы более всего выражены при нарушениях артериальной гемодинамики. При венозном стазе отмечены пре- и миктурические симптомы умеренной и слабой степени выраженности и слабый болевой синдром. Наличие в группе с системным атеросклерозом корреляции между симптомами и сниженным артериальным кровотоком в простате подтверждает полученные нами ранее данные об ишемическом генезе боли в тазовом регионе. Эти находки убедительно доказывают немаловажную роль нарушений тазовой гемодинамики в развитии СХТБ и формировании СНМП.
Для оценки предположения, что ишемия простаты является причиной тазового болевого синдрома нами, были выполнены следующие исследования:
1. Трансректальное ультразвуковое исследование (УЗИ) простаты с применением цветного дуплексного картирования.
2. Ангио-СКТ таза.
Трансректальный (Тр) ультразвук простаты является стандартизованным методом в урологии. ТрУЗИ простаты выполняется в комбинации серошкального исследования и высокоэнергетического допплера для оценки анатомии и кровоснабжения исследуемого органа [18].
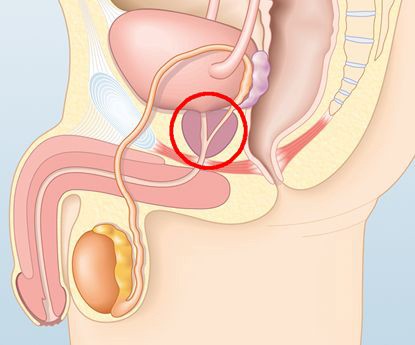
Существующими на сегодняшний день исследованиями сосудистой анатомии простаты [19, 20] определено, что артериальный приток крови к органу осуществляется из ветвей правой и левой нижних пузырных, внутренних срамных и геморроидальных артерий. Ветви этих сосудов ветвятся по капсуле простаты и снабжают паренхиму по периферии органа. Часть из них проникает через паренхиму органа и оказывает артериальную поддержку простатической части уретры (рис. 8).
В отечественной и зарубежной литературе имеются единичные работы [21–24], в которых при помощи трансректального цветного дуплексного картирования оценивается гемодинамика предстательной железы. При этом на сегодняшний день нормативные стандартизованные динамические и статические показатели оценки кровотока предстательной железы не выработаны и не введены в практическую деятельность, а работы по исследованию кровотока простаты при СХТБ/ХП не нашли пока применения в клинической практике.
Проведенные нами исследования по оценке тазовой гемодинамики путем применения трансректального дуплексного картирования простаты у пациентов с СХТБ III и здоровыми добровольцами позволили уточнить нормативные показатели артериальной поддержки простаты [25, 26] и продемонстрировали явные различия в скорости артериального простатического кровотока в группах ХП III А и ХП III Б.
Показатели артериальной гемодинамики в группе III A имеют меньшие параметры, чем в контроле. Но результаты статистически недостоверны (p>0,05). В то же время гемодинамические параметры в группе III Б в 88,6% случаев снижены более чем вдвое по сравнению с контролем при статистической достоверности результатов (табл. 3).
Такая же закономерность прослежена и при анализе плотности сосудистого русла по периферии и в центре простаты (рис. 9–11). Кроме того, у ряда пациентов с III Б при допплер-исследовании отмечено отсутствие капсулярных сосудов с той или иной стороны органа.
Кроме того, дуплексное картирование простаты было выполнено нами в следующем режиме: цветной допплер – лечебный массаж простаты – цветной допплер. Результаты показали, что лечебный массаж простаты приводит к достоверному улучшению артериального кровотока у 80% пациентов с ХП III A, но практически не влияет на артериальную гемодинамику у пациентов с ХП III Б и волонтеров (табл. 4, рис. 12). Отсутствие гемодинамических изменений после массажа при ХП III Б подтверждает полученные нами ранее при допплер-исследовании данные об органических изменениях артериального русла у этих пациентов, что позволяет уверенно говорить о хронической артериальной недостаточности простаты и, что наиболее вероятно, ишемическом генезе болевого синдрома.
Относительно целесообразности выполнения ангио-СКТ таза при диагностике СХТБ в современной литературе нет сбалансированного мнения. Руководства по диагностике СХТБ рекомендуют метод только как дифференциальный этап. Показанием к ангио-СКТ в нашей работе мы считали обнаружение измененной артериальной анатомии простаты, по данным дуплексного картирования органа.
В результате было установлено, что в 80% случаев имеет место асимметрия сосудистого русла простаты и мочевого пузыря вплоть до отсутствия мелких сегментарных сосудов (рис. 13, 14).
После получения диагностических подтверждений нашей гипотезы об ишемии предстательной железы как источнике болевого синдрома в тазовом регионе части пациентов с СХТБ III Б мы выполнили трансректальную пункционную биопсию простаты. Полученный материал был исследован путем стандартной и электронной микроскопии, а также иммуногистохимически (рис. 15–17).
Анализируемая ткань представлена обширными полями фиброза. Мышцы: межмускулярный фиброз, нарушение ориентации миофибрилл, сокращено количество плотных телец. Артерии: сосуды артериального типа имеют резко утолщенную, гиалинизированную стенку. Сосуды капиллярного типа деформированы, их просвет сокращен, с конгломератами эритроцитов. Нервы: нервные волокна немногочисленны, встречаются миелиновые фигуры в аксоплазме – признаки дегенерации.
По данным морфологического исследования, у всех пациентов отмечены обширные поля фиброза с резко выраженным межмышечным фиброзом, разобщение мышечных волокон. Снижено количество сосудов и нервных волокон, дегенерация немногочисленных нервных волокон, гиалинизация и утолщение стенок артериол. БЧльшая часть капилляров спавшаяся, в просвете – конгломераты эритроцитов. Эти находки являются прямым следствием хронической ишемии простаты. Не исключено, что связаны с врожденным дефектом сосудистой системы таза или простаты.
Заключение
СХТБ – широкое понятие, включающее не только патологию простаты, но и поражение других органов таза.
Существует много различных клинических форм, основным проявлением которых является боль. Но далеко не всегда можно найти лабораторное подтверждение воспаления существующими диагностическими приемами.
Основываясь из сути представленного материала, на сегодняшний день точка зрения нашей научной группы на патогенез ХП/СХТБ выглядит следующим образом.
Воспалительный СХТБ – это локальная воспалительная патология. Имеющееся воспаление в простате, носящее наиболее вероятно инфекционный характер, приводит к активации местного кининогенеза, что приводит, с одной стороны, к нарушению гематопростатического барьера, а с другой – к гипоксии и развитию оксидативного стресса. Вследствие этих изменений активируется ККС крови с повышением продукции оксида азота. В результате формируется отек органа и патологический тонус мускулатуры простаты, клинически выражающиеся в нарушениях эректильной функции, боли и СНМП.
ХП/СХТБ III Б является системной или органной сосудистой патологией, не имеющей отношения к ХП. Диагноз устанавливается у мужчин, жалующихся на хроническую тазовую боль, но имеющих незаконченное или нерезультативное обследование. Одной из возможных причин тазовой боли может являться ишемия простаты, врожденная или приобретенная. Например, как известно, активно протекающий атерогенез объясняется воспалительным процессом сосудистой стенки. Декомпенсация кининогенеза наступает вследствие нарушений общей или тазовой гемодинамики. Эти два процесса формируют повреждение гематопростатического барьера. Уже имеющиеся эндотелиальная дисфункция и активный местный кининогенез приводят к еще большим нарушениям микроциркуляции. Формируется тканевая гипоксия. Эти процессы формируют дисфункцию простаты, что клинически проявляется симптомокомплексом, схожим с таковым при воспалительном синдроме – нарушениях эрекции, боли и симптомах нарушенного мочеиспускания.
По нашему мнению, рассматриваемые формы СХТБ имеют при схожей клинической картине абсолютно разный патогенез. С другой стороны, нельзя забывать о том, что определенная часть заболеваний может скрываться под маской СХТБ и являться недиагностированной рутинной патологией. Основной принцип, лежащий в основе оценки состояния мужчин с ХП/СХТБ: необходимо пытаться выявить специфические и, надо надеяться, излечимые причины тазовой боли. У большинства мужчин таких причин выявить не удается. Однако важно не пропустить обратимую причину симптомов у этих пациентов.
Пациентов должен мониторировать специализированный врач, так как патология может проявиться со временем новыми симптомами и с неожиданной стороны.
Литература
1. McNaughton-Collins M, Stafford RS, O\’Leary MP, Barry MJ. How common is prostatitis? A national survey of physician visits. J Urol 1998; 159: 1224–8.
2. Moon TD, Hagen L, Heisey DM. Urinary symptomatology in younger men. Urology 1997; 50: 700–3.
3. De la Rosette JJ, Hubregtse MR, Karthaus HF, Debruyne FM. Results of a questionnaire among Dutch urologists and general practitioners concerning diagnostics and treatment of patients with prostatitis syndromes. Eur Urol 1992a; 22: 14–9.
4. Roberts RO, Lieber MM, Rhodes T et al. Prevalence of a physician-assigned diagnosis of prostatitis: The Olmsted County Study of Urinary Symptoms and Health Status Among Men. Urology 1998; 51: 578–84.
5. Wessely S, Nimnuan C, Sharpe M. Functional somatic syndromes: one or many? Lancet 1999; 354 (9182): 936–9.
6. Potts J, Moritz N, Everson D et al. Chronic abacterial prostatitis: a functional somatic syndrome? J Urol 2001; 165 (Suppl.): 25.
7. Potts JM. Chronic pelvic pain syndrome: a non-prostatocentric perspective. World J Urol 2003; 21: 54–6.
8. Ku JH, Kim ME, Lee NK, Park YH. Influence of environmental factors on chronic prostatitis-like symptoms in young men: results of a communitybased survey. Urology 2001; 58: 853–8.
9. Litwin MS, McNaughton-Collins M, Fowler FJ Jr et al. The National Institutes of Health chronic prostatitis symptom index: development and validation of a new outcome measure. Chronic Prostatitis Collaborative Research Network. J Urol 1999; 162: 369–75.
10. Turner JA, Hauge S, VonKorff M et al. Primary care and urology patients with male pelvic pain syndrome: symptoms and quality of life. J Urol 2002; 167: 1768–73.
11. True LD, Berger RE, Rothman I et al. Prostate histopathology and the chronic prostatitis/chronic pelvic pain syndrome: a prospective biopsy study. J Urol 1999; 162: 2014–8.
12. Schaeffer AJ, Knauss JS, Landis JR et al. Leukocyte and bacterial counts do not correlate with severity of symptoms in men with chronic prostatitis: the National Institutes of Health Chronic Prostatitis Cohort Study. J Urol 2002; 168 (3): 1048–53.
13. Nickel JC, Alexander RB, Schaeffer AJ et al. Leukocytes and bacteria in men with chronic prostatitis/chronic pelvic pain syndrome compared to asymptomatic controls. J Urol 2003; 170: 818–22.
14. Schaeffer AJ, Knauss JS, Landis JR et al. Leukocyte and bacterial counts do not correlate with severity of symptoms in men with chronic prostatitis: the National Institutes of Health Chronic Prostatitis Cohort Study. J Urol 2002; 168 (3): 1048–53.
15. Меньшикова Е.Б., Ланкин В.З., Зенков Н.К. и др. Окислительный стресс (прооксиданты и антиоксиданты). М.: Институт физиологии СО РАМН, 2006.
16. Wendel A. Enzymes acting against reactive oxygen. Enzymes – Tools and Targets. Basel: Karger, 1988; p. 161–7.
17. Kogan M, Belousov I, Shangichev A et al. Relationship of lower urinary tract symptoms and chronic pelvic pain syndrome in men with pelvic hemodynamic disorders. 24th Annual EUA Congress, Stockholm 2009. Abstr 552. Eur Urol Suppl 2009; 7 (3): 158.
18. Ultrasound Findings in Patients With Chronic Prostatitis/Chronic Pelvic Pain Syndrome. Wee A, Shoskes D. Current Prostate Reports 2008, 6: 182–4. Current Medicine Group LLC. ISSN 1544–1865.
19. Clegg EJ. The arterial supply of the human prostate and seminal vesicles. J Anat 1955; 89: 209–17.
20. Neumaier, Martinoli C, Derchi L, Silvestri E, Rosenberg I. Normal Prostate Gland: Examination with Color Doppler US. Radiology 1995; 196: 453–7.
21. Шолохов В.Н. Ультразвуковая томография и допплерография в диагностике рака предстательной железы. Визуализация в клинике. 2002; 20: 51–6.
22. Максимов В.А., Борисик В.И., Прохоров А.В. и др. Применение энергетической допплерангиографии для диагностики острых воспалительных заболеваний почек, предстательной железы и органов мошонки. Эхография. 2004; 5 (1): 50–6.
23. Rifkin MD, Sudakoff CS, Alexander AA. Prostate: techniques, results, and potential applications of color Doppler US scanning. Radiology 1993; 186: 509–13.
24. McLeary RD. Color Doppler imaging of the vascular anatomy of the prostate (abstr). Radiology 1993; 189 (P): 155.
25. Kogan M., Belousov I et al. Transrectal color doppler-ultrasonographical imaging of prostate. 21 st Annual EUA Congress, France Paris 2006. Abstract 905 Eur Urol Suppl 2006; 5 (2): 249.
26. Kogan M, Belousov I et al. Transrectal color Doppler imaging in chronic prostatitis IIIB. Ultrasound Med Biol 2006; 32 (5): 97.
Источник: consilium-medicum.com